Introducción
- La fisiología cardiovascular a menudo se describe considerando el corazón y el sistema arterial como los actores principales.
- Este enfoque pone en el centro del paradigma la función cardíaca y sus determinantes (precarga, poscarga y contractilidad) y las propiedades del sistema arterial (resistencia y compliance).
- En 1884, Bayliss y Starling diseñaron el concepto de una presión vascular estática a flujo cero, llamada la “presión arterial general media” (mean general blood pressure)
- En 1954, Guyton propuso un modelo para el retorno venoso y definió sus determinantes, incluyendo la presión media de llenado sistémico (Pmsf).
- Guyton describió cada condición hemodinámica dependiendo de estos determinantes.
- Este modelo ha sido objeto de controversia, aunque sigue siendo el más adecuado para describir la fisiopatología de la insuficiencia circulatoria.
- En los últimos años, se han desarrollado métodos que permiten estimar los determinantes del retorno venoso junto a la cama del paciente.
- Estos métodos han facilitado varios estudios fisiológicos, que ya no se realizan en animales, sino en pacientes críticamente enfermos y postoperatorios.
¿Qué genera el gasto cardíaco (GC)?
- Una forma de entender el funcionamiento del sistema cardiovascular es pensar que la presión producida por el ventrículo izquierdo genera el flujo y propulsa la sangre desde la aorta hacia la aurícula derecha.
- Sin embargo, esta visión probablemente sea inexacta.
- De acuerdo con la teoría de Guyton, el gasto cardíaco está gobernado principalmente por el flujo venoso.
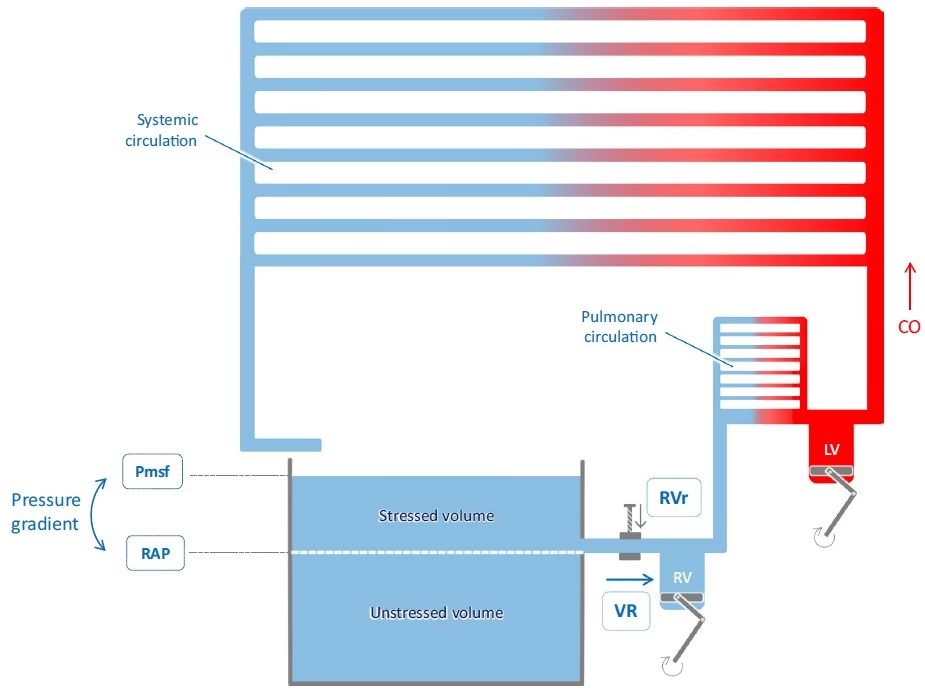
- El flujo sanguíneo sistémico es generado por la diferencia de presión entre las venas y vénulas, por un lado, y la aurícula derecha, por el otro, con el corazón vaciando la aurícula derecha y manteniendo baja la presión auricular derecha (PAD) (Figura 1).
- Así, el flujo sanguíneo se genera mediante el vaciado del sistema venoso, más que por la eyección hacia la red arterial.
- Según esta teoría, la PAD, es decir, la presión de retroceso del flujo venoso obstaculiza el retorno venoso.
- Guyton postuló que existe una presión de avance que impulsa el flujo hacia la aurícula derecha, denominada presión media de llenado sistémico (Pmsf).
- Esta presión resulta del potencial de retroceso elástico almacenado en las paredes de las venas.
- En este contexto, el rol del corazón puede verse como el de mantener una diferencia significativa entre la Pmsf y la PAD:
- Cuanto más potente es la bomba, más baja es la PAD, mayor es la diferencia entre la Pmsf y la PAD, y mayor es el retorno venoso.
- En cada contracción, el corazón vacía el ventrículo derecho, permitiendo que la presión de retroceso elástico en las venas y vénulas drene sangre de regreso a la aurícula derecha.
- El volumen de sangre que ha sido removido de las venas y vénulas para rellenar las cavidades derechas se añade luego al circuito arterial en el otro lado.
- El rol del corazón izquierdo es eyectar la sangre hacia el circuito de alta presión, asegurando su distribución en el sistema resistivo.
¿Cuál es el rol del sistema venoso?
- Según este modelo, centrado en la importancia del retorno venoso, es la Pmsf y NO la presión arterial, la que impulsa el flujo hacia la aurícula derecha.
- Magder y De Varennes compararon acertadamente el sistema cardiovascular con una bañera, llena de agua por un grifo y vaciada a través de un agujero ubicado en el costado de la bañera (Figura 1).
- El flujo que sale de la bañera, análogo al retorno venoso, está determinado únicamente por la presión hidrostática del agua por encima del agujero, no por la presión del agua que sale del grifo, que se asemeja al gasto cardíaco, ya que esta presión es baja en comparación con el volumen de la bañera.
- En el «modelo de la bañera», el sistema venoso desempeña el papel de la bañera, y el grifo, es decir, el gasto cardíaco, solo llena la bañera.
- El papel de la presión hidrostática que impulsa el agua fuera de la bañera es desempeñado por la presión generada por el retroceso elástico del sistema venoso.
- El volumen que estira las paredes elásticas de las venas proporciona la energía potencial que genera el flujo.
- Sin embargo, como cualquier estructura elástica (por ejemplo, un globo), las venas tienen un volumen de reposo que no tensa sus paredes elásticas y no crea presión.
- Este volumen, que no contribuye al flujo venoso, se llama volumen sanguíneo no estresado.
- En el modelo de la bañera de Magder y De Varennes, este volumen corresponde al volumen de agua por debajo del agujero.
- Cualquier cantidad de sangre añadida al reservorio venoso producirá tensión en sus paredes e incrementará la presión intravascular.
- Esta parte de la sangre venosa (el volumen de agua por encima del agujero) se denomina volumen sanguíneo estresado (Figura 1).
- El sistema venoso es grande: en un humano adulto, contiene aproximadamente el 70% del volumen sanguíneo total, es decir, 5 L, con alrededor del 70% en el lecho vascular esplácnico.
- Además, la compliance venosa es 40 veces mayor que la compliance arterial.
- En condiciones normales, el volumen sanguíneo no estresado en humanos representa aproximadamente el 70% del volumen sanguíneo total.
- Este volumen representa una gran reserva de importancia primordial, que puede ser reclutada mediante una constricción venosa mediada por α-adrenérgicos.
- Esta venoconstricción mueve parte del volumen sanguíneo no estresado al volumen sanguíneo estresado.
¿Cuáles son los determinantes del retorno venoso?
La curva de retorno venoso:
- El retorno venoso es el flujo sanguíneo que cruza ambas venas cavas.
- Según la ley de Poiseuille, está determinado por la resistencia al retorno venoso (RVr) y por el gradiente de presión entre la presión aguas abajo, es decir, la presión auricular derecha (PAD), y la presión aguas arriba, que es la presión media de llenado sistémico (Pmsf) (Figura 1):
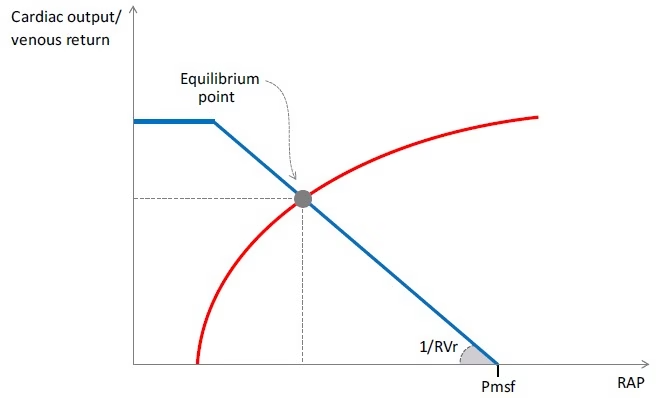
- Retorno Venoso = (Pmsf – PAD) / RVr
- Cuando la PAD disminuye, el gradiente de presión entre la PAD y la Pmsf aumenta, y el retorno venoso también aumenta.
- Sin embargo, cuando la PAD disminuye por debajo de un valor crítico, el retorno venoso ya no aumenta más (Figura 2).
- Este plateau corresponde al fenómeno de la “cascada vascular” o “limitación del flujo”, que ocurre cuando las venas colapsan porque su presión intramural se vuelve menor que la presión extramural.
- En este gráfico, se observa que la Pmsf puede estimarse mediante la intersección de la curva de retorno venoso con el eje X, ya que, en ausencia de flujo (flujo cero), la PAD es igual a la Pmsf.
- La resistencia al retorno venoso (RVr) está representada por el inverso de la pendiente de la curva (Figura 2).
Guyton, Frank y Starling en una sola figura.
- El sistema cardiovascular es un circuito cerrado.
- En equilibrio, el retorno venoso es igual al gasto cardíaco (Figura 1).
- El gasto cardíaco se adapta a los cambios en el flujo venoso mediante el mecanismo de Frank-Starling.
- Cualquier aumento en la precarga ventricular incrementa el grado de interacción entre los filamentos de actina y miosina, aumentando la contractilidad intrínseca del corazón y el volumen sistólico.
- Sin embargo, cuando los miofilamentos se estiran a su longitud máxima, cualquier aumento adicional de la precarga cardíaca ya no incrementa el volumen sistólico:
- Los ventrículos se vuelven no sensibles a la precarga.
- Sin embargo, cuando los miofilamentos se estiran a su longitud máxima, cualquier aumento adicional de la precarga cardíaca ya no incrementa el volumen sistólico:
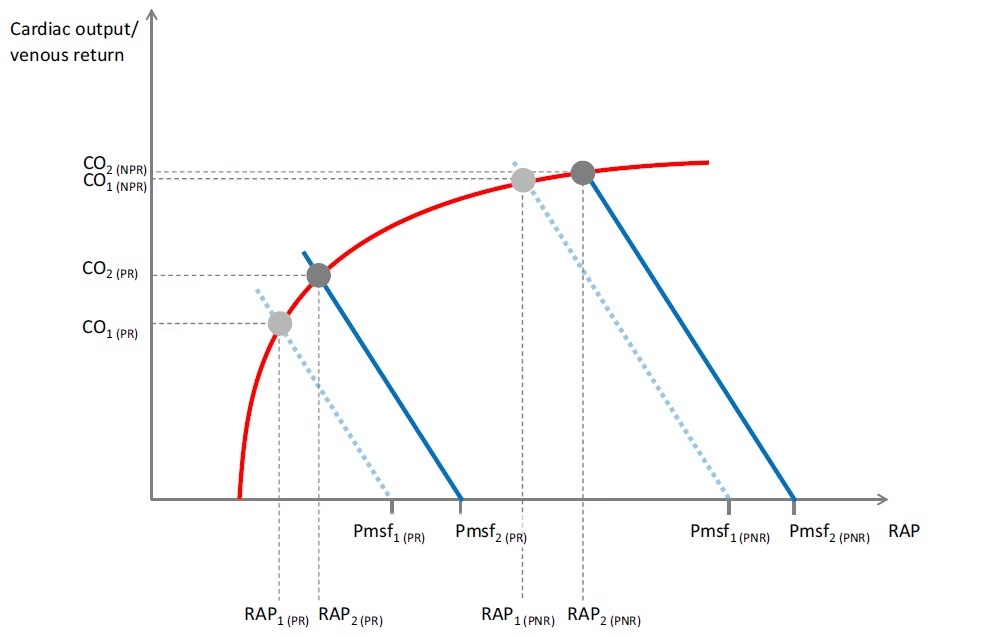
- Dado que el retorno venoso y el gasto cardíaco son iguales, y que la PAD es un marcador de la precarga cardíaca, es posible superponer las curvas de retorno venoso y de función cardíaca (Figura 2).
- La intersección de estas curvas define un punto de operación en equilibrio.
- Sus coordenadas (PAD y retorno venoso/gasto cardíaco) y la Pmsf (intersección en el eje X de la curva de retorno venoso) describen las características hemodinámicas bajo la condición estudiada (Figura 2).
- Esta representación permite la descripción de todos los estados hemodinámicos patológicos.
¿Qué cambia el retorno venoso?
Presión Media Sistémica de Llenado (Pmsf)
- La Pmsf está determinada por el volumen en las grandes vénulas complacientes y venas pequeñas.
- Es cercana a la presión media de llenado circulatorio, que es la presión a la que convergen las presiones arteriales y venosas centrales cuando no hay flujo.
- Esta presión media de llenado circulatorio es generada por el retroceso elástico de todo el circuito cardiovascular.
- Es diferente de la Pmsf, que es la presión generada únicamente por el retroceso elástico de las vénulas y pequeñas venas.
- Sin embargo, distinguir entre la Pmsf y la presión media de llenado circulatorio no es clínicamente importante porque son muy similares [11, 25], excepto en algunas circunstancias específicas (hipertensión pulmonar y gasto cardíaco muy bajo).
- El valor normal de la Pmsf varía entre los estudios y probablemente entre especies [2, 26–28].
- En condiciones normales en humanos, la Pmsf está entre 2–10 mmHg [11].
- En pacientes, la Pmsf varía dependiendo de las circunstancias clínicas, el estado de volumen y el tono vasomotor.
- En pacientes sometidos a cirugía cardíaca y con choque séptico, se han reportado valores de 15–33 mmHg [29].
- Estos valores son más altos que en condiciones normales debido a tratamientos como la infusión de líquidos y vasopresores.
- El aumento de la PAD, por ejemplo, durante la ventilación con presión positiva [30], también lleva a un aumento en la Pmsf, lo que mantiene un gradiente de presión suficiente para el retorno venoso.
- Durante un paro cardíaco, se estiman valores más bajos, lo cual se explica por un estado hemodinámico diferente [29, 31].
Presión de la Aurícula Derecha (PAD)
- La PAD (presión auricular derecha) está influenciada principalmente por la eficiencia de la bomba cardíaca: cuanto más eficiente sea, más baja será la PAD.
- También se ve afectada por cambios en la presión pleural durante la ventilación, lo que contribuye a la variación respiratoria del volumen sistólico.
- Cabe destacar que la PAD que se opone al retorno venoso es la presión intramural de la aurícula derecha, no la presión transmural.
Resistencia al Retorno Venoso
- La RVr (resistencia al retorno venoso) está influenciada principalmente por el diámetro de las venas, que está controlado por el sistema simpático. La RVr también puede aumentar en casos de presión extramural elevada.
- Dos factores de igual importancia pueden modificar la Pmsf:
- El volumen de sangre en el reservorio venoso, que se incrementa con la administración de líquidos.
- La capacitancia del sistema venoso, que está bajo el control del tono adrenérgico.
- El concepto de resistencia al retorno venoso es quizás más complejo, aunque la descripción basada en la ley de Poiseuille ayuda a comprender sus aplicaciones clínicas.
- Guyton observó que los cambios en la resistencia tienen un efecto importante sobre el retorno venoso cuando ocurren cerca de la aurícula derecha, pero tienen un efecto menor cuando los cambios se producen más lejos
- Guyton sugirió definir la “resistencia periférica al retorno venoso” como la suma de la resistencia venosa y arterial.
¿Cómo medir los determinantes del retorno venoso?
Parada Cardíaca
- Las primeras mediciones de la Pmsf en humanos se realizaron durante estudios de electrofisiología.
- Se asume que la presión media circulatoria es la presión a la que convergen la presión arterial y la presión venosa central (PVC) después de una fibrilación ventricular.
- Parece que estas presiones convergen después de 7 segundos, aunque se han reportado períodos más largos, posiblemente debido a una limitación del flujo.
- Más recientemente, la Pmsf se ha medido en unidades de cuidados intensivos en cadáveres, un minuto después de una muerte esperada.
- Cabe señalar que este método NO permite estimar la RVr (resistencia al retorno venoso).
El método de interacción corazón-pulmón
- Este método fue desarrollado en pacientes intubados por Maas y sus colegas, quienes aprovecharon inteligentemente las interacciones corazón-pulmón.
- Durante una pausa al final de la inspiración, la presión intratorácica aumenta, lo que eleva la PAD (estimada a través de la PVC) y disminuye el gasto cardíaco (un sustituto del retorno venoso).
- Por el contrario, durante una pausa al final de la espiración, la PAD disminuye y el gasto cardíaco aumenta (Figura 3).
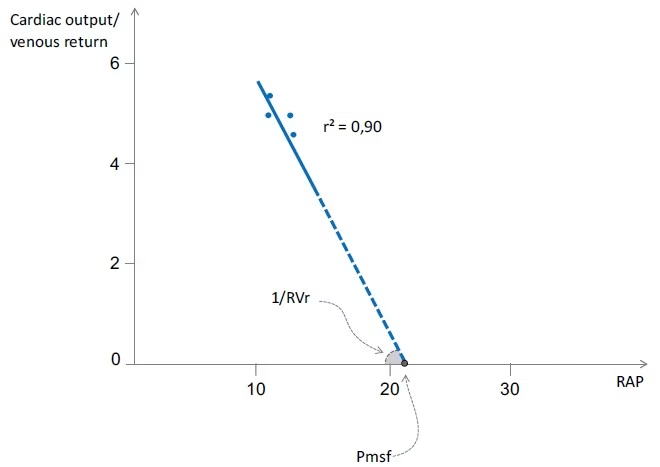
- Se trazan en un gráfico los pares de valores de PVC y gasto cardíaco.
- La línea de regresión entre estos puntos estima la curva de retorno venoso.
- La Pmsf se estima por el valor de la PVC en la intersección con el eje X, y la RVr estima como el inverso de la pendiente.
- Limitaciones:
- Puede verse afectado por el retraso en la medición de la presión del pulso arterial en relación con el flujo de retorno venoso.
- Cualquier error en la medición de la PVC puede introducir un error significativo en la pendiente de la curva y en la estimación de la Pmsf.
- También sobrestima la Pmsf, y su precisión puede estar influenciada por el estado de volumen del paciente.
El método de interrupción transitoria del flujo en el brazo.
- Este método reproduce el método de parada cardíaca, pero a nivel del brazo.
- Después de una oclusión rápida mediante un manguito de presión en el brazo, las presiones arterial y venosa medidas aguas abajo se equilibran a un nivel de presión que estima la Pmsf.
- Este método ha sido validado en humanos en comparación con el método de interacciones corazón-pulmón.
- Limitaciones:
- El compartimento venoso en el músculo es menos complaciente que en el lecho vascular esplácnico.
- Puede considerarse más cualitativo que cuantitativo.
Estimación matemática: el método de Parkin y Leaning
- Un análogo de la Pmsf puede estimarse a partir de los valores reales de presión arterial media (PAM), presión auricular derecha (PAD) y gasto cardíaco, utilizando la siguiente fórmula:
- Pmsf (analogue) = a × PAD + b × PAM + c × gasto cardiaco
- En esta fórmula, a y b son constantes adimensionales (a + b = 1).
- Las variaciones de la Pmsf estimadas por este método durante la expansión de volumen son consistentes con el modelo de Guyton, lo que sugiere su validez.
- Sin embargo, el hecho de que este método no evalúe la RVr (resistencia al retorno venoso) puede afectar su fiabilidad.
- Aun así, el método ha sido validado en comparación con la Pmsf determinada en el equilibrio completo de presión arterio-venosa y con la Pmsf estimada por el método de interacciones corazón-pulmón.
¿Cuáles son los patrones típicos de los determinantes del retorno venoso en situaciones clínicas comunes?
Choque hipovolémico.
- Durante la hipovolemia, el volumen sanguíneo estresado disminuye junto con el volumen sanguíneo total.
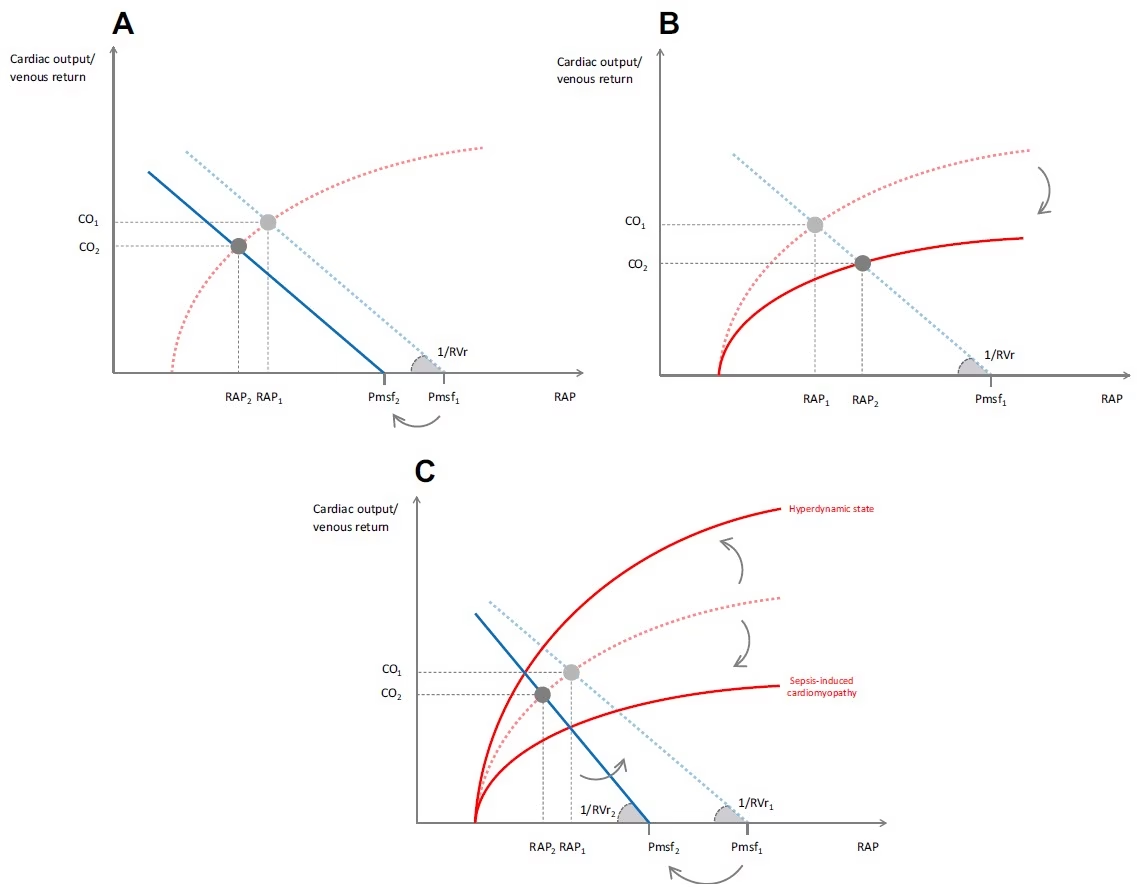
- La Pmsf se reduce, mientras que la RVr no se modifica (Figura 4A).
- El punto de equilibrio se desplaza hacia abajo y a la izquierda, y la línea de la curva de retorno venoso se desplaza hacia la izquierda sin cambiar su pendiente.
- En el caso de una respuesta a la precarga, el retorno venoso y el gasto cardíaco disminuyen.
- En presencia de hipotensión, este fenómeno es rápidamente contrarrestado por la estimulación simpática, que moviliza la reserva fisiológica de volumen sanguíneo no estresado, actuando como una especie de «autoexpansión de volumen«.
Choque cardiogénico.
- La disfunción ventricular sistólica disminuye la pendiente de la curva de Frank-Starling (Figura 4B) sin modificar la Pmsf ni la RVr.
- El punto de equilibrio se desplaza hacia abajo y a la derecha, siguiendo la nueva curva de Frank-Starling: PAD aumenta y el gradiente (Pmsf – PAD) disminuye (Figura 4B).
- Una vez que ocurre la estimulación refleja simpática, aparecen dos efectos principales.
- Primero:
- La capacitancia venosa disminuye y, por lo tanto, la Pmsf aumenta.
- Este mecanismo tiene poco efecto.
- El punto de equilibrio se encuentra en la parte plana de la curva de Frank-Starling, lo que provoca que la PAD aumente en la misma proporción que la Pmsf y el gradiente de retorno venoso no aumente significativamente.
- Por la misma razón, la expansión de volumen, en teoría, no puede restaurar el gasto cardíaco en esta situación.
- Este mecanismo tiene poco efecto.
- La capacitancia venosa disminuye y, por lo tanto, la Pmsf aumenta.
- Segundo:
- El reclutamiento simpático de una reserva de contractilidad, que tiende a aumentar la pendiente de la curva de Frank-Starling.
- Primero:
- La Dobutamina afecta los tres determinantes del retorno venoso.
- Aumenta la pendiente de la curva de función cardíaca.
- Disminuye la poscarga del ventrículo derecho por vasodilatación pulmonar , esto disminuye la PAD.
- Induce vasodilatación venosa a través de los receptores betaadrenérgicos vasculares,
- Estos efectos son superados por el efecto inotrópico, de modo que el gasto cardíaco aumenta.
Choque séptico
- La fuerte dilatación venosa aumenta el volumen sanguíneo no estresado y disminuye la Pmsf.
- La fuga capilar contribuye a este fenómeno (Figura 4C) [46, 47].
- En humanos con choque séptico y aumento del gasto cardíaco, la vasodilatación puede ser responsable de una fuerte disminución en la RVr.
- La función cardíaca también puede verse afectada.
- La vasodilatación arterial disminuye la poscarga del ventrículo izquierdo, aumentando así la pendiente de la curva de Frank-Starling.
- Esto puede explicar un aumento del gasto cardíaco durante el clásico «estado hiperdinámico» (Figura 4C).
- Este aumento en el gasto cardíaco también puede estar parcialmente vinculado a la disminución en la RVr.
- Por el contrario, la disfunción sistólica cardíaca inducida por sepsis [48] aplana la curva de Frank-Starling, lo que tiende a disminuir el retorno venoso y el gasto cardíaco en asociación con la disminución de la Pmsf (Figura 4C).
Ventilación mecánica
- Los efectos de la ventilación sobre el retorno venoso probablemente difieren según se considere la ventilación tidal o el efecto de altas presiones intratorácicas.
- Un aumento en la presión positiva al final de la espiración (PEEP), transmitida a la aurícula derecha, aumenta la PAD.
- Esto se acompaña de un aumento en la Pmsf, debido a la transmisión de presión al lecho vascular esplácnico.
- Este aumento en la Pmsf no compensa completamente el aumento concomitante de la PAD, pero la diferencia es mínima, por lo que el retorno venoso no cambia significativamente.
- Se ha descrito un aumento en la RVr con niveles elevados de PEEP.
- Se cree que esto es consecuencia de la limitación del flujo, lo que colapsa las grandes venas en su unión con la aurícula derecha.
- Sin embargo, este aumento en la RVr solo se ha reportado en estudios donde se han utilizado niveles altos de PEEP.
- Parece estar ausente en niveles de PEEP ≤ 10 cmH₂O.
- Así, la disminución del gasto cardíaco inducida por niveles moderados de PEEP se debe principalmente a un aumento de la poscarga del ventrículo derecho.
- Los efectos de la ventilación tidal sobre la Pmsf parecen ser mínimos.
- Sin embargo, se han descrito pequeñas variaciones, posiblemente debido a una transferencia de volumen sanguíneo desde el compartimento pulmonar al venoso.
¿Cómo puede cambiar la práctica clínica la fisiología del retorno venoso?
Expansión de volumen y la importancia de la PVC
- Como se ha demostrado en pacientes críticamente enfermos, la administración de líquidos tiene el efecto opuesto a la hipovolemia, ya que aumenta el volumen sanguíneo estresado y la Pmsf.
- Contrario a lo que se podría esperar por la disminución del tono simpático, la RVr (resistencia al retorno venoso) permanece sin cambios.
- Sin embargo, los pacientes con y sin respuesta a la precarga se comportan de manera diferente.
- Un bolo de líquidos aumenta la Pmsf en la misma proporción, independientemente del grado de respuesta a la precarga.
- En el caso de respuesta a la precarga, como la curva de Frank-Starling es empinada, la expansión de volumen aumenta más la Pmsf que la PAD (Figura 5).
- El gradiente (Pmsf – PAD) aumenta.
- Como la RVr no cambia, el retorno venoso y el gasto cardíaco aumentan.
- En el caso de falta de respuesta a la precarga, la expansión de volumen aumenta la Pmsf en la misma proporción, pero el aumento de la precarga ventricular no se traduce en un aumento del volumen sistólico.
- La presión ventricular telediastólica aumenta, lo que provoca un aumento significativo de la PAD.
- Así, la PAD y la Pmsf aumentan en la misma medida, y el gradiente de retorno venoso permanece sin cambios (Figura 5).
- Comprender estos efectos fisiológicos de los líquidos ayuda a interpretar la PVC durante la infusión de estos.
- A menudo se piensa que la PVC debería aumentar con la administración de líquidos.
- Sin embargo, hemos visto que, por el contrario, en pacientes con respuesta a la precarga, la PVC no debería aumentar demasiado, permitiendo así que el gradiente de retorno venoso aumente.
- El mismo error se ha cometido en relación con la elevación pasiva de piernas (PLR).
- Es fisiológicamente incorrecto afirmar que la PLR no es lo suficientemente eficaz si la PVC no aumenta.
La elevación pasiva de piernas (PLR) es en realidad un “pseudo reto de líquidos”.
- La PLR imita un bolo de líquidos al transferir sangre venosa desde los miembros inferiores y el lecho vascular esplácnico hacia el corazón.
- La Pmsf aumenta durante la PLR sin cambiar la RVr, debido al aumento del volumen sanguíneo estresado, de manera similar a la expansión de volumen.
- Los determinantes del retorno venoso durante la PLR se comportan de la misma manera que durante la infusión de líquidos, dependiendo del grado de respuesta a la precarga.
- La PLR puede generar falsos negativos en pacientes con hipertensión intraabdominal.
- Esto puede explicarse a la luz de los efectos de la PLR sobre el retorno venoso:
- La hipertensión intraabdominal disminuye el volumen del lecho vascular esplácnico y limita el reclutamiento de volumen sanguíneo estresado por la PLR.
- Además, en algunos pacientes con hipertensión intraabdominal muy elevada e hipovolemia profunda, el retorno venoso podría verse limitado por la compresión de la vena cava inferior, generando un fenómeno de limitación del flujo.
- Esto puede explicarse a la luz de los efectos de la PLR sobre el retorno venoso:
Revisión de los efectos de la norepinefrina.
- La norepinefrina suele administrarse con el objetivo de aumentar el tono y la presión arteriales media.
- No obstante, los datos sugieren que sus efectos venosos también son significativos.
- El reclutamiento del volumen sanguíneo no estresado puede, en teoría, equivaler a una expansión de volumen de un litro.
- La norepinefrina en realidad aumenta la precarga cardíaca, lo que resulta en un aumento del gasto cardíaco en pacientes con respuesta a la precarga.
- Este aumento de la precarga cardíaca se debe al reclutamiento del volumen no estresado mediante venoconstricción, lo que reduce la capacitancia venosa.
- Cabe señalar que este efecto es de corta duración debido a la fuga capilar.
- La Pmsf comienza a disminuir tan solo 40 minutos después de un aumento inicial inducido por norepinefrina.
- A través de la estimulación β1, la norepinefrina también ejerce un efecto inotrópico que puede contribuir al aumento del gasto cardíaco.
- Sin embargo, estos efectos pueden verse contrarrestados por un aumento inducido por la norepinefrina en la RVr.
- Estudios en animales sugieren que la norepinefrina aumenta la Pmsf .
- En un modelo de choque séptico inducido por endotoxinas en cerdos, Datta y Magder reportaron que este aumento en la Pmsf no estuvo acompañado por un aumento en la RVr.
- De manera similar, en pacientes sépticos, la reducción de la dosis de norepinefrina disminuyó la Pmsf y redujo la RVr en menor medida.
- Como consecuencia, el gradiente (Pmsf – PAD) disminuyó, lo que provocó una reducción en el retorno venoso y en el gasto cardíaco en pacientes con respuesta a la precarga.
- Por el contrario, aumentar la dosis de norepinefrina en pacientes con choque séptico debería aumentar la Pmsf mientras aumenta la RVr de manera más modesta.
- Este menor efecto de la norepinefrina sobre la RVr en comparación con la Pmsf se ha atribuido al hecho de que la activación de los receptores α-adrenérgicos constriñe el drenaje venoso del lecho vascular esplácnico.
- Curiosamente, se han descrito efectos distintos de la norepinefrina en otro contexto.
- En pacientes sometidos a cirugía cardíaca, aumentar la dosis de norepinefrina redujo el gasto cardíaco en la mitad de los pacientes porque el aumento de la RVr fue mayor que el aumento de la Pmsf.
- Este efecto diferente de la norepinefrina en pacientes de cirugía cardíaca podría explicarse por un grado diferente de vasodilatación en comparación con el choque séptico.
- El análisis de los efectos de la expansión de volumen a la luz de la fisiología del retorno venoso nos ayuda a comprender la sinergia entre la expansión de volumen y la norepinefrina.
- Tanto la norepinefrina como los líquidos contribuyen al aumento de la Pmsf.
- Más allá de este efecto «aditivo», la norepinefrina y la infusión de líquidos pueden actuar de manera sinérgica.
- Una vez que se ha iniciado o aumentado la norepinefrina, cualquier infusión adicional de líquidos puede aumentar la Pmsf en mayor medida que antes.
- El aumento del volumen sanguíneo estresado inducido por líquidos ocurre cuando los líquidos se administran en una red venosa constreñida en lugar de en un sistema venoso amplio y dilatado.
- Todos estos argumentos respaldan la administración temprana de norepinefrina junto con líquidos durante la reanimación del choque séptico, especialmente en pacientes con hipotensión grave.
- La norepinefrina no solo es el único medio para restaurar rápidamente la presión arterial, sino que también potencia los efectos de la administración de líquidos.
- Esto puede reducir la cantidad total de líquidos administrados durante la reanimación y, por lo tanto, mejorar los resultados.
- Tanto la norepinefrina como los líquidos contribuyen al aumento de la Pmsf.
Posición prono
- Aunque la posición en decúbito prono se ha convertido en una piedra angular en el manejo del síndrome de dificultad respiratoria aguda, sus efectos hemodinámicos han sido escasamente descritos.
- En primer lugar, la posición en decúbito prono reduce la resistencia arterial pulmonar y disminuye la poscarga del ventrículo derecho.
- Es probable que esto se deba a diversos factores, como la reducción de la vasoconstricción hipóxica e hipercápnica y el llenado de los vasos pulmonares, lo que aumenta la proporción de vasos en zonas no 1 de West.
- En segundo lugar, la posición en decúbito prono también aumenta la precarga cardíaca a través del incremento de la presión intraabdominal, lo que a su vez aumenta el gasto cardíaco en pacientes con respuesta a la precarga.
- Este efecto no es despreciable, ya que el gasto cardíaco puede aumentar hasta un 20 % en caso de respuesta a la precarga, en un rango similar al de una infusión de 500 mL de solución salina.
- En primer lugar, la posición en decúbito prono reduce la resistencia arterial pulmonar y disminuye la poscarga del ventrículo derecho.
- En el caso de respuesta a la precarga, la Pmsf aumentó más que la PAD, permitiendo que el gradiente (Pmsf – PAD) aumentara.
- El aumento de la RVr tras el incremento de la presión intraabdominal fue moderado y mucho menor que el aumento del gradiente (Pmsf – PAD).
- Por lo tanto, el retorno venoso y el gasto cardíaco aumentaron en los pacientes con respuesta a la precarga.
- En el caso de ausencia de respuesta a la precarga, la PAD aumentó en una proporción similar a la Pmsf, de modo que el gradiente (Pmsf – PAD), el retorno venoso y el gasto cardíaco se mantuvieron sin cambios.
- Sin embargo, en algunos pacientes con respuesta a la precarga, el aumento de la RVr fue tan grande que superó el incremento del gradiente (Pmsf – PAD).
- En estos pocos pacientes, incluso en presencia de respuesta a la precarga, el retorno venoso y el gasto cardíaco no aumentaron con la posición en decúbito prono.
- De hecho, el incremento de la RVr probablemente dependió del aumento de la presión intraabdominal, pero también del volumen sanguíneo central, ya que la hipovolemia puede promover la limitación del flujo a través de la oclusión de la vena cava inferior durante la posición en decúbito prono.
Conclusiones
- El retorno venoso desempeña un papel fundamental en la fisiología cardiovascular, y sus determinantes, Pmsf, RAP y RVr, son variables hemodinámicas clave.
- El modelo de Guyton ayuda a describir su interacción.
- Aunque durante mucho tiempo los determinantes del retorno venoso solo fueron estudiados en animales, recientemente se han desarrollado métodos innovadores para estimarlos en pacientes críticamente enfermos.
- Estos métodos han permitido comprender mejor el valor de la PVC en la evaluación de la respuesta a la administración de líquidos.
- Además, se ha demostrado claramente el efecto venoso de la norepinefrina durante el choque séptico, lo que respalda su administración junto con líquidos en pacientes con hipotensión.
- Finalmente, la fisiología del retorno venoso explica el aumento significativo de la precarga cardíaca durante la posición en decúbito prono.