Introducción
- La lesión medular aguda (LMA) es una condición grave que puede resultar en la pérdida permanente de la función neurológica dentro de los primeros días posteriores a una lesión en la médula espinal.
- Más allá de la descompresión quirúrgica urgente, el aumento de la presión arterial media (PAM) sigue siendo uno de los pocos tratamientos médicos disponibles para mejorar la perfusión de la médula espinal y la entrega de oxígeno.
- Esto tiene como objetivo reducir el daño isquémico secundario en el tejido neural vulnerable salvable y mejorar los desenlaces neurológicos.
- La inestabilidad hemodinámica, y en particular la hipotensión sistémica, definida como PAS < 90 mmHg, es deletérea para la médula espinal lesionada y debe corregirse de inmediato.
- La isquemia y la hipoperfusión desempeñan un papel importante en la progresión de los mecanismos de lesión secundaria después de una LMA, lo que convierte la optimización de la perfusión medular en un punto importante en la reanimación de estos pacientes.
- La vulnerabilidad del tejido medular a la isquemia está respaldada por hallazgos que muestran que pequeños cambios en la PAM y en la presión de perfusión medular (PPM) —que es la diferencia entre la MAP y la presión intratecal (PIT)— se correlacionan con desenlaces neurológicos después de una LMA.
- Los estudios han demostrado que una diferencia de apenas 2–3 mmHg en la PAM durante los primeros tres días posteriores a la lesión podría distinguir entre pacientes que no se recuperaron neurológicamente y aquellos que mejoraron al menos un grado en la Escala de Deterioro de la Asociación de Lesión Medular Americana (ASIA/AIS), lo que subraya los efectos terapéuticos críticos de mantener umbrales de PAM en el período agudo temprano de la LMA.
- Mantener una PAM adecuada se ha asociado fuertemente con mejoras en el subpuntaje motor de la AIS, y evidencia emergente sugiere beneficios potenciales en los subpuntajes sensoriales, destacando el papel vital de la optimización hemodinámica en la mejoría de la perfusión medular y la recuperación neurológica integral.
- Las guías de 2013 de la American Association of Neurological Surgeons (AANS) y del Congress of Neurological Surgeons (CNS) proporcionaron recomendaciones detalladas para el manejo hemodinámico de la LMA, enfatizando el mantenimiento de una PAM adecuada para mejorar la perfusión medular y los resultados neurológicos.
- Los avances recientes y la evidencia acumulada han llevado a una re-evaluación de este enfoque.
- En las guías actualizadas de 2024, el uso de la PPM como marcador de perfusión y la comprensión de la utilización de vasopresores como dopamina, norepinefrina, fenilefrina y dobutamina en el manejo de la LMA, enfatizando las estrategias en evolución para la optimización hemodinámica.
¿Qué recomiendan las guías?
- Las guías del 2013 de la AANS/CNS para el manejo hemodinámico de la LMA proporcionaron tres recomendaciones clave de nivel III:
- Utilizar dispositivos de monitoreo en un entorno de cuidados críticos para detectar problemas cardiovasculares y respiratorios.
- Tratar de manera inmediata la TAS < 90 mmHg.
- Mantener una PAM de 85–90 mmHg durante los primeros siete días posteriores a la lesión.
- Estas tienen varias limitaciones como la falta de orientación sobre la elección de vasopresores, la dependencia de evidencia de baja calidad y la aparición de nuevos datos.
- El rango estrecho de PAM de 85–90 mmHg resultó difícil de mantener con vasopresores convencionales, lo que llevó a muchos centros a adoptar un objetivo de PAM de al menos 85 mmHg sin un límite superior.
- Esto generó la necesidad de recomendaciones más claras y flexibles que tuvieran en cuenta la variabilidad clínica.
- Aunque las dos primeras recomendaciones siguen siendo pilares en el manejo de la LMA, las guías de 2024 ahora sugieren un rango más amplio de PAM, recomendando 75–80 mmHg como límite inferior y 90–95 mmHg como límite superior durante 3–7 días de tratamiento.
- Las guías aún no ofrecen objetivos específicos para PPM (Presión de Perfusión Medular) ni para la elección de vasopresores debido a la escasez de evidencia disponible.
- Existe evidencia conflictiva respecto a los objetivos más altos de PAM; mientras algunos estudios sugieren mejores desenlaces con PAM > 85 mmHg durante tres días, otros indican que las mejoras neurológicas se estabilizan más allá de 95 mmHg, ofreciendo beneficios adicionales limitados.
- Dado el soporte limitado para objetivos más altos de PAM, el grupo desarrollador de guías (GDG) recomendó no exceder los 90–95 mmHg, citando los riesgos potenciales del uso de vasopresores.
- Estos rangos de objetivos más flexibles permiten a los clínicos adaptar las metas de PAM en función de las necesidades individuales de cada paciente y de las circunstancias clínicas.
Autorregulación hemodinámica
- Después de una LMA, los mecanismos de autorregulación del cuerpo para mantener un flujo sanguíneo adecuado a la médula espinal a menudo se ven gravemente comprometidos, lo que conduce a una presión arterial alterada y a una perfusión medular deteriorada.
- Normalmente, el aporte sanguíneo a la médula espinal está estrictamente regulado por procesos de autorregulación que aseguran una perfusión estable a pesar de las fluctuaciones en la presión arterial sistémica.
- Esta regulación implica una compleja interacción de factores neuronales, humorales y locales que ajustan el tono vascular en respuesta a los cambios en el flujo sanguíneo y la presión.
- Después de una LMA, estos mecanismos se interrumpen debido al daño directo en la médula espinal, lo que provoca hipotensión sistémica, bradicardia y vasodilatación por debajo del nivel de la lesión, que en conjunto deterioran la capacidad de la médula espinal para autorregular su suministro sanguíneo.
- La fisiopatología de la alteración de la presión arterial en la LMA es multifactorial.
- La pérdida del tono simpático debido a la lesión interrumpe el equilibrio normal entre vasoconstricción y vasodilatación, lo que conduce a una actividad parasimpática no contrarrestada.
- Esto resulta en una vasodilatación profunda, particularmente en los lechos vasculares por debajo del nivel de la lesión, contribuyendo a la hipotensión.
- La médula espinal misma se vuelve más vulnerable a la isquemia, ya que se pierden las respuestas autorregulatorias para mantener la presión de perfusión.
- La barrera hematoencefálica comprometida y el edema local exacerban aún más esta situación, lo que conduce a una lesión isquémica secundaria.
- La incapacidad para mantener una PAM y PPM adecuadas puede, por lo tanto, provocar un daño irreversible al tejido neural y malos desenlaces neurológicos.
Vulnerabilidad regional a la isquemia
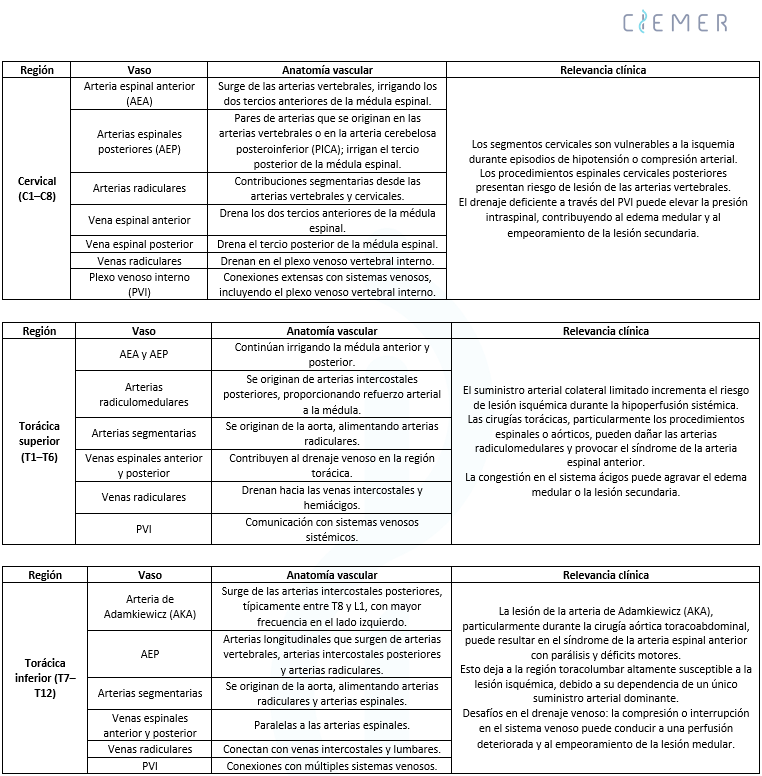
- La vulnerabilidad de diferentes regiones de la médula espinal a la isquemia está influenciada tanto por factores anatómicos como fisiopatológicos, lo que resalta la necesidad de un manejo hemodinámico matizado según las características de la lesión (Tabla 1).
- La vascularización de la médula espinal se abastece principalmente de:
- La arteria espinal anterior (0.2–0.8 mm)
- La arteria espinal posterolateral (0.1–0.4 mm)
- La arteria radicularis magna o arteria de Adamkiewicz (0.5–1.2 mm)
- La médula cervical, con su mayor demanda metabólica relativa y dependencia de la arteria espinal anterior, puede ser más susceptible a la isquemia en comparación con los segmentos torácicos o lumbares.
- La elevada actividad metabólica de la médula cervical se atribuye a la alta densidad de neuronas motoras dentro del engrosamiento cervical, que facilita la compleja inervación de las extremidades superiores.
- La médula cervical maneja un volumen sustancial de vías sensoriales ascendentes y motoras descendentes debido a su proximidad anatómica al cerebro, lo que intensifica aún más sus requerimientos metabólicos.
- Las variaciones en el suministro vascular también contribuyen a diferentes presentaciones clínicas de lesión:
- El síndrome de la arteria espinal anterior, que resulta en déficits motores y pérdida de la sensibilidad al dolor y la temperatura
- El síndrome de la arteria espinal posterior, que afecta la propiocepción y el sentido vibratorio.
- El síndrome de la arteria sulcal.
- El infarto del cono medular (que puede diagnosticarse erróneamente como síndrome de cauda equina).
- El infarto medular central (a menudo tras paro cardíaco o hipotensión severa prolongada), lo que ilustra la complejidad de la LMA isquémica.
- El mecanismo de la LMA también influye significativamente en el patrón y la severidad de la lesión isquémica.
- Las LMA traumáticas frecuentemente involucran disrupción vascular directa, compresión mecánica e isquemia inmediata.
- Las LMA no traumáticas, como las debidas a insuficiencia vascular o condiciones degenerativas, pueden causar daños isquémicos más graduales.
- Estas diferencias subrayan la necesidad de adaptar las intervenciones hemodinámicas, como los objetivos de PAM y la selección de vasopresores, según el mecanismo y el nivel neurológico de la lesión.
- Las LMA traumáticas cervicales, a menudo resultan en choque neurogénico caracterizado por bradicardia profunda, hipotensión y perdida de la regulación autonómica.
- Las LMA torácicas o lumbares, aunque menos propensas a producir choque neurogénico, pueden requerir estrategias distintas, como prevenir la estasis venosa y mantener la perfusión sistémica.
- Las LMA cervicales y torácicas altas interrumpen el flujo simpático mientras preservan la actividad parasimpática, lo que resulta en bradicardia, gasto cardíaco reducido e hipotensión, especialmente durante el esfuerzo o la posición erguida.
- La pérdida del tono vascular causa acumulación periférica de sangre y retorno venoso reducido.
- Estos pacientes tienen un alto riesgo de disreflexia autonómica, un síndrome potencialmente mortal desencadenado por estímulos nocivos, caracterizado por hipertensión súbita por debajo de la lesión y vasodilatación compensatoria por encima de la lesión.
- El manejo efectivo requiere monitoreo estricto, uso de vasopresores para mantener la PAM y prevención de desencadenantes.
- La heterogeneidad en presentaciones y complicaciones entre lesiones cervicales, torácicas y lumbares refleja la complejidad de la fisiopatología de la LMA, donde tanto los mecanismos de lesión primaria como secundaria —isquemia, inflamación y formación de cicatriz glial— difieren según el tipo y nivel de lesión.
Selección del vasopresor e inotrópico
- En el manejo de una LMA, se emplean vasopresores e inotrópicos para contrarrestar las alteraciones hemodinámicas aumentando la presión arterial sistémica y mejorando la perfusión de la médula espinal.
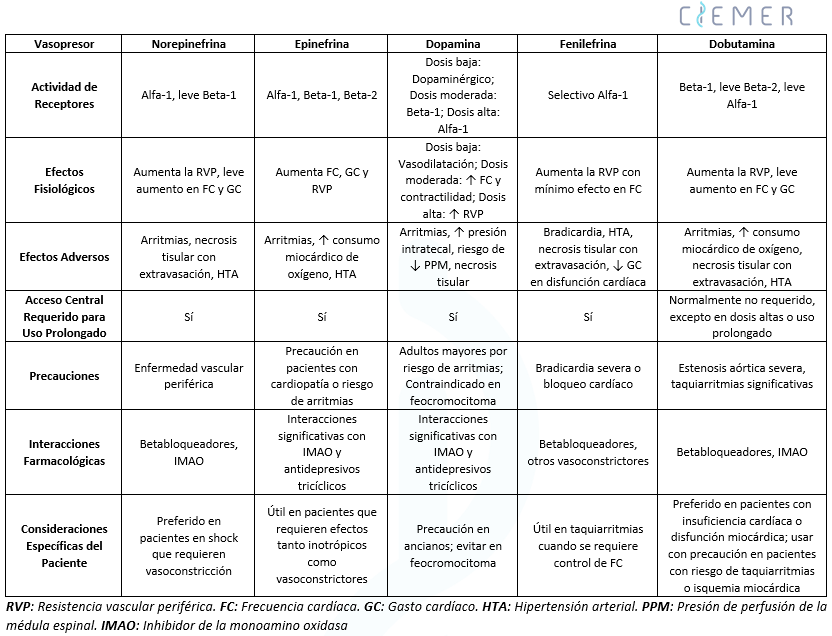
- Este proceso complejo requiere una comprensión de la fisiopatología del choque neurogénico y de los perfiles farmacológicos de los agentes disponibles, como norepinefrina, dopamina, fenilefrina y dobutamina.
- Los vasopresores (norepinefrina, fenilefrina) aumentan principalmente la resistencia vascular sistémica (RVS) mediante la vasoconstricción alfa-adrenérgica, apoyando la presión arterial y la perfusión.
- Los inotrópicos (dobutamina) mejoran la contractilidad miocárdica a través de la estimulación beta-1 adrenérgica, mejorando el gasto cardíaco.
- Algunos agentes como la dopamina y la epinefrina muestran efectos mixtos (vasopresores e inotrópicos) dependiendo de la dosis y de la actividad del receptor.
- Mientras que los vasopresores se utilizan típicamente para mantener la PAM, los inotrópicos se reservan para pacientes con disfunción cardíaca.
- El uso adaptado de estos agentes es esencial para afrontar los desafíos hemodinámicos específicos en la LMA (Tabla 2).
Norepinefrina:
- Primera línea en LMA aguda por sus potentes efectos alfa-adrenérgicos que aumentan la resistencia vascular periférica y contrarrestan la hipotensión severa del choque neurogénico.
- Actividad beta-adrenérgica leve → ligera mejora en la frecuencia cardíaca y contractilidad, útil en pacientes que se benefician de aumento del gasto cardíaco.
- Ventaja: Puede mantener o incluso reducir la presión intratecal, mejorando la PPM más eficazmente que otros vasopresores.
- Comparada con dopamina: +2 mmHg en perfusión medular sin diferencias en PAM.
- Precauciones: Riesgo de isquemia periférica en enfermedad vascular; uso prolongado requiere acceso venoso central por riesgo de necrosis tisular.
- Modelos animales → superior a fenilefrina en restaurar flujo y oxigenación medular.
Dopamina:
- Efectos dependientes de la dosis:
- Bajas dosis → receptores dopaminérgicos → vasodilatación renal y mesentérica (puede ser contraproducente en LMA).
- Dosis moderadas → beta-adrenérgicos → ↑ frecuencia y contractilidad, útil en disfunción cardíaca.
- Altas dosis → alfa-adrenérgicos → ↑ resistencia vascular.
- Problemas: ↑ presión intratecal y ↓ PPM, empeorando desenlaces neurológicos.
- Asociada a mayor riesgo de arritmias y lesión miocárdica, sobre todo en adultos mayores.
- Contraindicada en feocromocitoma.
- Generalmente menos preferida.
Epinefrina (Adrenalina):
- Potente agonista beta y alfa → ↑ frecuencia, gasto cardíaco y resistencia vascular.
- Riesgos: taquiarritmias, ↑ consumo de O₂ miocárdico.
- Generalmente reservada para hipotensión refractaria cuando otros vasopresores fallan.
- Uso limitado, requiere monitoreo estricto.
Fenilefrina:
- Agonista alfa-1 selectivo → potente vasoconstrictor.
- No aumenta el gasto cardíaco → limitada en pacientes con disfunción miocárdica.
- Útil cuando la norepinefrina está contraindicada o en presencia de taquiarritmias.
- Requiere acceso venoso central para uso prolongado.
- Precaución en bradicardia severa o bloqueo cardíaco.
- Datos experimentales → norepinefrina más eficaz que fenilefrina en perfusión y oxigenación medular.
Dobutamina:
- Agonista beta-1 → ↑ contractilidad y gasto cardíaco.
- Actividad alfa-1 leve y beta-2 → vasodilatación ligera.
- Riesgo de taquiarritmias y ↑ consumo de O₂ miocárdico.
- No aumenta significativamente la resistencia vascular sistémica → no se usa sola en hipotensión por choque neurogénico.
- Suele combinarse con otros vasopresores en pacientes con disfunción cardíaca severa.
- Generalmente no requiere acceso central salvo dosis altas/prolongadas.
- Preferida en pacientes con insuficiencia cardíaca.
- Aunque es esencial para mantener la PAM en el manejo de la LMA, la terapia con vasopresores se asocia con riesgos significativos.
- Los estudios han reportado altas tasas de complicaciones cuando se utilizan vasopresores para sostener una PAM > 85 mmHg en pacientes críticamente enfermos, con un 74–94% de los pacientes presentando taquicardia, bradicardia, fibrilación auricular, taquicardia ventricular y niveles elevados de troponina.
- Aunque la mayoría de estas complicaciones no fueron potencialmente mortales, los vasopresores pueden aumentar el riesgo de eventos graves, como arritmias cardíacas fatales, lesión miocárdica, acidosis y necrosis cutánea.
- La terapia con vasopresores se ha vinculado con complicaciones más allá de los efectos cardiovasculares directos.
- La evidencia sugiere que su uso se asocia de manera independiente con tasas más altas de infecciones y complicaciones procedimentales, incluyendo neumonía, trombosis venosa profunda, intervenciones quirúrgicas no planificadas e infecciones del sitio quirúrgico, lo que indica un impacto farmacológico más amplio que el mero control de la presión arterial.
- Algunos estudios han encontrado que mantener la PAM > 85 mmHg durante períodos más cortos (3–7 días) no incrementa significativamente el riesgo de eventos graves como hemorragia, accidente cerebrovascular o infarto de miocardio, lo que resalta la importancia de equilibrar cuidadosamente la duración e intensidad del uso de vasopresores para minimizar el daño potencial.
Presión de Perfusión Medular (PPM)
- Aunque los objetivos de la PAM han sido ampliamente estudiados en el manejo de la LMA, evidencia emergente sugiere que la PPM puede ser un determinante más crítico de la recuperación neurológica.
- El aumento de la PPM se ha vinculado con mejoras significativas en los desenlaces neurológicos a los 6 y 12 meses, lo que subraya su papel potencial en la mejora de la perfusión y oxigenación del tejido neural después de una LMA.
- Aunque la PAM se incrementa con el objetivo indirecto de mejorar la perfusión medular, apuntar directamente a la PPM puede ofrecer un enfoque más preciso para mitigar la lesión isquémica secundaria.
- La duroplastia ha surgido como una intervención clave para aumentar la PPM en pacientes con LMA al reducir eficazmente la presión intraspinal (PIS).
- Los métodos tradicionales, como la laminectomía sola, han demostrado ser inadecuados para aliviar la PIS o aumentar lo suficiente la PPM, ya que la propia duramadre a menudo actúa como fuente de compresión sobre la médula lesionada.
- En contraste, la duroplastia, que implica la descompresión dural y la aplicación de un parche dural artificial, ha demostrado mejoras significativas en parámetros fisiológicos críticos, incluidos PIS y PPM.
- Combinar laminectomía con duroplastia ha mostrado expandir significativamente el espacio intradural, llevando a una descompresión más eficaz y sostenida de la médula espinal en comparación con la laminectomía sola.
- Esto se evidencia con mejoras marcadas en la PPM y reducciones en la PIS y en el índice de reactividad de presión vascular (sPRx), lo que indica una mejor respuesta vascular medular, que podría ayudar a prevenir lesión isquémica secundaria.
- Ensayos clínicos fase III en curso, como el DISCUSS trial (Duroplasty for Injured Cervical Spinal Cord with Uncontrolled Swelling), refuerzan el potencial de la duroplastia no solo para mejorar la PPM en el período temprano postlesión, sino también para promover la recuperación funcional a largo plazo, consolidando su papel como componente crítico en el manejo quirúrgico de LMA.
- La monitorización de la PPM presenta desafíos debido a su naturaleza invasiva, que requiere catéteres intradurales y puede ocasionar complicaciones como fugas de líquido cefalorraquídeo (LCR) y pseudomeningocele.
- A pesar de estos riesgos, los estudios han reportado complicaciones significativas mínimas asociadas con la monitorización de PPM y drenaje de LCR, sugiriendo que sigue siendo un adjunto viable en casos seleccionados.
- El rango óptimo de PPM aún está en investigación, con estudios que sugieren que mantenerla por encima de 50 mmHg, pero por debajo de 110 mmHg podría ser beneficioso.
- Las comparaciones entre PPM y PAM indican que la PPM se correlaciona más estrechamente con la recuperación neurológica, mientras que depender únicamente de los objetivos de PAM podría no ser tan eficaz.
- Dada la falta de objetivos de PPM establecidos, las dificultades prácticas en su medición y las técnicas variables, las guías actuales continúan recomendando centrarse en los objetivos de PAM como un enfoque más accesible y ampliamente aceptado para el manejo de la LMA.
- Esta postura pragmática refleja la necesidad continua de más investigación para refinar las técnicas de monitorización de PPM y las intervenciones mecánicas como la duroplastia, junto con el uso de vasopresores, para definir mejor sus roles en la optimización de desenlaces en pacientes con LMA.
Implicaciones
- Las guías actualizadas CNS/AANS sobre el manejo hemodinámico de la LMA proporcionan recomendaciones débiles para mantener la PAM entre 75–80 mmHg como límite inferior y 90–95 mmHg como límite superior, con una duración de tratamiento de 3–7 días.
- Estas recomendaciones reflejan la baja calidad de la evidencia disponible actualmente, así como el impacto reconocido que pequeñas fluctuaciones en PAM y PPM pueden tener sobre los resultados neurológicos debido a la mayor vulnerabilidad de la médula espinal a la isquemia.
- Es importante destacar que las guías actuales se basan predominantemente de estudios enfocados en lesiones cervicales traumáticas, dejando importantes vacíos en la comprensión del manejo hemodinámico óptimo para otros mecanismos y niveles de lesión, como las LMA no traumáticas o las lesiones de la médula torácica y lumbar.
- Estas variaciones en el suministro vascular, la demanda metabólica y las presentaciones de lesión resaltan la necesidad de una evidencia más amplia para desarrollar recomendaciones integrales que aborden la heterogeneidad de la fisiopatología de la LMA.
- La literatura existente sobre los objetivos de PAM en el manejo de LMA está limitada por varios factores clave.
- La mayoría de los estudios reportan asociaciones más que relaciones causales entre los umbrales de PAM y los resultados de recuperación, lo que dificulta establecer conclusiones definitivas.
- Los factores específicos del paciente como el grado AIS, la presencia de lesiones concomitantes y las comorbilidades subyacentes pueden alterar significativamente el impacto de la PAM sobre los resultados neurológicos, complicando aún más la interpretación de los datos.
- Muchos de los estudios revisados tuvieron tamaños de muestra pequeños, poblaciones de pacientes restringidas y se centraron en intervalos específicos posteriores a la lesión, limitando la generalización de sus hallazgos a la población general de pacientes con LMA.
- Las guías previas de 2013 sugerían mantener la PAM entre 85–90 mmHg, pero la inconsistencia y variabilidad en las recomendaciones de límite inferior en los estudios en los que se basaban subraya la necesidad de evidencia más sólida para refinar estos objetivos.
- En cuanto a la duración óptima del manejo hemodinámico, la evidencia sugiere que sostener la PAM en los primeros días posteriores a la lesión es crítico, con algunos estudios indicando que extender este soporte hasta 7 días puede mejorar aún más los resultados neurológicos.
- Estos estudios con frecuencia no abordan de manera completa el impacto de la variabilidad en la severidad de las lesiones y los requerimientos hemodinámicos individuales, lo que resalta la necesidad de un enfoque flexible.
- Como resultado, el GDG recomendó un rango de tratamiento de 3–7 días, permitiendo a los clínicos adaptar la duración según las necesidades específicas del paciente, las características de la lesión y la respuesta clínica.
- Además de las intervenciones farmacológicas como los vasopresores, intervenciones mecánicas como la duroplastia han mostrado promesa para mejorar directamente la PPM al reducir la presión intraspinal y aliviar la compresión, optimizando aún más la perfusión y contribuyendo a mejores resultados neurológicos.
- La elección del vasopresor o inotrópico en el manejo de la LMA debe personalizarse a la condición clínica específica del paciente, considerando factores como el nivel y severidad de la lesión, la presencia de disfunción cardiopulmonar y comorbilidades.
- En pacientes con condiciones cardíacas preexistentes pueden beneficiarse más de agentes como la dobutamina, que mejora el gasto cardíaco, mientras que aquellos con hipotensión significativa pueden requerir los potentes efectos vasoconstrictores de la norepinefrina o fenilefrina.
- Los riesgos de complicaciones como arritmias, lesión miocárdica y necrosis tisular deben ponderarse frente a los beneficios de aumentar la PAM.
- La inserción de acceso venoso central a menudo es necesaria para la administración prolongada de estos agentes, minimizando el riesgo de extravasación y daño tisular local, particularmente con fármacos como la norepinefrina y la fenilefrina.
- En última instancia, se justifica un enfoque personalizado que considere factores específicos del paciente, como la presencia de un catéter venoso central, la disfunción cardiopulmonar concomitante y las comorbilidades, junto con una estrecha monitorización de complicaciones al usar estos agentes para manejar LMA.
- Un importante vacío de conocimiento persiste respecto a la elección óptima de vasopresor para el manejo hemodinámico en pacientes con LMA.
- La evidencia actual no favorece de manera sólida un vasopresor sobre otro, dejando a los clínicos tomar decisiones basadas en la experiencia personal, los protocolos institucionales y las consideraciones específicas de cada paciente.
- Abordar este vacío a través de investigación dirigida es esencial para desarrollar guías basadas en evidencia que refinen la selección de vasopresores, mejoren el manejo hemodinámico y, en última instancia, optimicen los resultados neurológicos en pacientes con LMA.
- Ampliar nuestra comprensión de cómo diferentes vasopresores afectan la perfusión medular y la recuperación es crucial para avanzar en el cuidado de los pacientes con LMA aguda.
Conclusiones
- La LMA requiere un manejo hemodinámico preciso para optimizar la perfusión medular y prevenir la lesión isquémica secundaria.
- Las guías actualizadas del CNS/AANS recomiendan mantener la PAM entre 75–80 mmHg como límite inferior y 90–95 mmHg como límite superior durante 3–7 días, reflejando las limitaciones de la evidencia actual y la necesidad de un cuidado individualizado basado en las respuestas específicas de cada paciente.
- Aunque la PAM sigue siendo el foco central del tratamiento, la evidencia emergente sugiere que dirigir el objetivo directamente a la PPM, particularmente mediante intervenciones como la duroplastia, podría mejorar aún más los resultados al aliviar la presión intraspinal y mejorar la perfusión.
- La selección de vasopresores continúa siendo un aspecto crucial pero complejo en el manejo de la LMA, ya que ningún agente ha demostrado de manera definitiva ser superior en la mejoría de los resultados.
- La norepinefrina es frecuentemente favorecida por sus efectos equilibrados tanto en PAM como en PPM, pero la elección del agente debe ajustarse al perfil individual del paciente, considerando factores como la función cardíaca, la severidad de la lesión y las comorbilidades.
- Otros agentes, como la dopamina, la fenilefrina y la dobutamina, pueden ofrecer ventajas distintas dependiendo del escenario clínico, reforzando la necesidad de un enfoque personalizado en el manejo hemodinámico.
- La investigación en curso es crítica para avanzar en nuestra comprensión tanto de las estrategias farmacológicas como de las mecánicas en el cuidado de la LMA.
- A medida que evolucione la evidencia, será esencial refinar los protocolos de vasopresores e integrar intervenciones como la duroplastia para establecer guías integrales basadas en la evidencia que maximicen la recuperación neurológica y los resultados a largo plazo de los pacientes con SCI.

Especialista en medicina de emergencias – U. Icesi
Fellow de medicina critica y cuidado intensivo – U. Icesi
MsC en educación – U. del Rosario / U. Javeriana
Master en toxicología – U. Cardenal Herrera