Tabla de contenidos
Introducción
- El potasio (K+) es el catión intracelular predominante.
- Es esencial para la función de todas las células vivas.
- Su concentración intracelular es más de 30 veces su concentración extracelular.
- La concentración en el suero depende de su ingesta, excreción y distribución transcelular.
- La mayor parte del K+ del cuerpo está en los músculos.
- La aldosterona es el principal regulador de la excreción renal de K+.
- La hipoK es una de las alteraciones electrolíticas mas comunes en la practica clínica, donde la mayoría de los casos son leves.
- La hipoK (concentración de K+ en el suero < 3.5 mmol/l) tiene múltiples manifestaciones que afectan a diferentes sistemas orgánicos.
- Una historia clínica cuidadosa y pruebas de laboratorio básicas suelen ser suficientes para diagnosticar la mayoría de los casos de hipoK.
- El K+ debe ser reemplazado por vía oral siempre que sea posible.
- La reposición de K+ intravenoso es necesaria para el manejo de emergencia de la hipoK y en pacientes que no pueden tomar potasio oral.
Epidemiología
- La carga de la hipoK en la población general es difícil de estimar.
- Los estudios han mostrado que la prevalencia de hipoK en pacientes hospitalizados está entre el 14-40%, con el 5% de los pacientes mostrando niveles de K+ por debajo de 3.0 mmol/l.
- En una población ambulatoria sometida a pruebas de laboratorio, se encontró hipoK leve en casi el 14%.
- El sexo femenino, la edad joven, una Tasa de Filtración Glomerular estimada (TFGe) y el uso de diuréticos se asociaron con un aumento del riesgo de hipoK.
- Aproximadamente el 80% de los pacientes que reciben diuréticos experimentan hipoK en algún momento.
- Muchos de los pacientes que sufren de hipoK también padecen de una enfermedad sistémica asociada.
- Los pacientes con alteraciones psiquiátricas tienen un riesgo mayor de hipoK probablemente debido a la terapia farmacológica.
- Los pacientes en diálisis peritoneal también tienen un riesgo elevado de desarrollar hipoK; probablemente en relación a perdida de K+ en el liquido peritoneal, infecciones y mala nutrición.
- También se ha descrito una forma de pseudohipoK relacionada con cambios estacionales (verano) en la temperatura ambiente, atribuida a incrementos metabólicos en la actividad de la Na+,K+ATPasa (‘bomba de sodio’) y la captación celular de K+.
- HipoK en pacientes con enfermedad cardiovascular:
- La prevalencia de hipoK en pacientes con enfermedad cardíaca es alta.
- La prevalencia depende de:
- El tiempo desde el diagnóstico hasta la medición del K+.
- La severidad de la enfermedad.
- Las comorbilidades concurrentes.
- La definición de hipoK utilizada en los estudios.
- La magnitud del uso de diuréticos en la población estudiada.
- Si los estudios se realizaron antes o después de la introducción de beta-bloqueantes e inhibidores del sistema renina-angiotensina-aldosterona como terapia estándar para diferentes enfermedades cardiovasculares.
- Entre los pacientes con enfermedad cardiovascular:
- La mayor prevalencia de hipoK se observó en pacientes con insuficiencia cardíaca crónica (incidencia del 3.0-54%).
- En pacientes con hipertensión, los estudios mostraron una prevalencia entre el 3.8% y el 7.2% y una incidencia del 3.5-6.8%.
Clasificación
- Hipokalemia leve: 3.5 – 3.0 mmol/l
- Hipokalemia moderada: 3.0 – 2.5 mmol/l
- Hipokalemia severa: <2.5 mmol/l
Homeostasis
- El K+ juega un rol clave en el mantenimiento de la función celular normal, detallado de la siguiente manera:
- El K+ es el catión intracelular principal, crucial para la función de prácticamente todas las células.
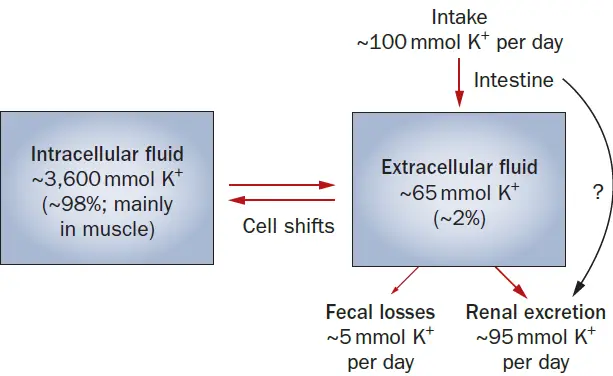
- En humanos, la concentración intracelular de K+ es aproximadamente 150 mmol/l, mientras que la concentración extracelular es de 3.5-5 mmol/l.
- En una dieta occidental es de 60-140 mmol/día.
- Los riñones excretan el 90% de la ingesta diaria, mientras que el 10% restante se excreta en las heces.
- La cantidad excretada en las heces aumenta en la enfermedad renal avanzada, como en pacientes en diálisis.
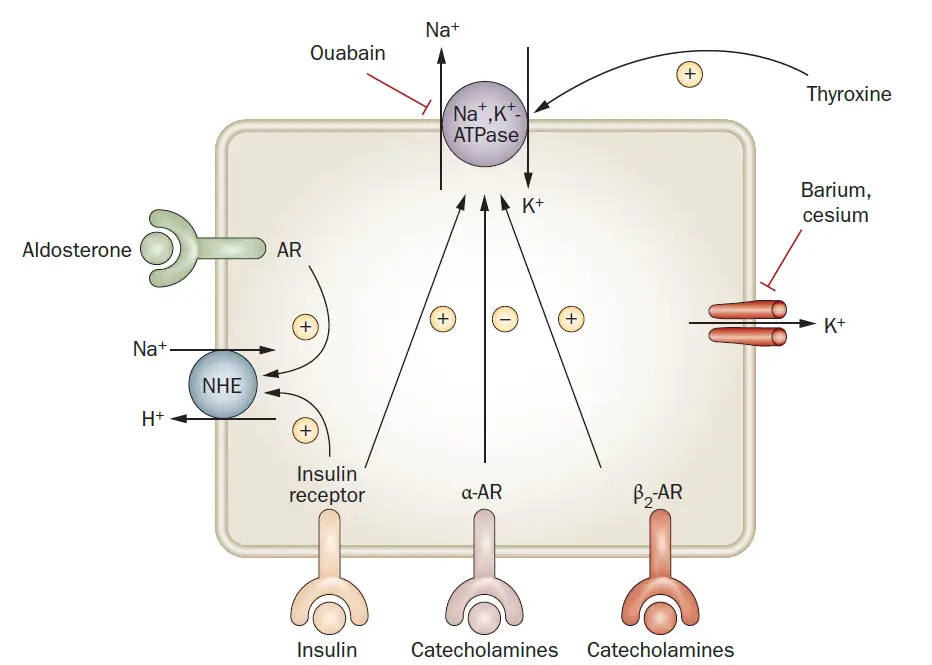
- Casi todas las células contienen la bomba Na+-K+-ATPasa que transporta sodio (Na+) fuera de la célula y K+ hacia dentro, estableciendo un gradiente de K+ a través de la membrana celular (K+ dentro > K+ fuera).
- Este gradiente es parcialmente responsable de mantener la diferencia de potencial a través de la membrana.
- Los músculos contienen el 70% del total de K+ corporal, mientras que el hígado, los eritrocitos y los huesos contienen cada uno aproximadamente el 7%.
- La diferencia de potencial es fundamental para el funcionamiento de tejidos excitables como los nervios y músculos.
- Solo el 2% del K+ se encuentra en el líquido extracelular (LEC), con una concentración de solo 4 mmol/L.
- Solo es de 60-80 mmol, o aproximadamente el 2% del total de K+ corporal, mientras que el contenido intracelular de K+ es de 3000-4000 mmol.
- Las actividades enzimáticas, así como la división y crecimiento celular, son catalizadas por el K+ y afectadas por sus concentraciones y sus alteraciones.
- El K+ intracelular participa en la regulación ácido-base intercambiando por iones de hidrógeno extracelulares (H+) y afectando la tasa de producción de amonio renal.
- Existen para contrarrestar las alteraciones del K+, manteniendo una distribución adecuada de K+ en el cuerpo y regulando el contenido total de K+.
- El exceso de K+ en el LEC disminuye el potencial de membrana, mientras que la hipoK causa hiperpolarización y no respuesta de la membrana.
- La alteración del equilibrio del potasio (hipoK o hiperk) puede llevar a alteraciones de la conducción eléctrica del corazón, arritmias y muerte súbita.
- El equilibrio del K+ tiene un efecto negativo directo en el equilibrio de H+ a nivel intracelular y extracelular y en la actividad celular total.
- Insulina: Desplaza el K+ hacia el espacio intracelular activando la bomba Na+-K+-ATPasa.
- El mismo efecto se logra con las catecolaminas activando los receptores β2.
- Después de una comida, la secreción de insulina traslada el K+ hacia el interior de la célula hasta que es excretado por el riñón, previniendo la hiperK.
- Acidosis Metabólica Hiperclorémica con Brecha Aniónica Normal (acidosis mineral): Resulta en la salida de K+ de las células y un aumento en el K+ extracelular. Esto se debe al efecto de la acidosis mineral en el intercambiador Na+/H+ en el músculo esquelético.
- Acidosis Metabólica de Alto Gap Aniónico (acidosis orgánica) y acidosis respiratoria tienen un efecto mínimo en la distribución de K+.
- Osmolalidad Sérica: Un aumento en la osmolalidad sérica, como en la hiperglucemia, resultará en el movimiento de agua fuera de la célula y, posteriormente, la salida de K+. Esto elevará el K+ en los liquidos extracelulares.
- Excreción de K+ en los Riñones y Ritmo Circadiano: La excreción de K+ sigue un ritmo circadiano. La excreción de K+ es menor durante la noche y las primeras horas de la mañana, e incrementa a medida que avanza el día, coincidiendo con el aumento de la ingesta de alimentos ricos en K+.
Transporte de potasio en el riñón
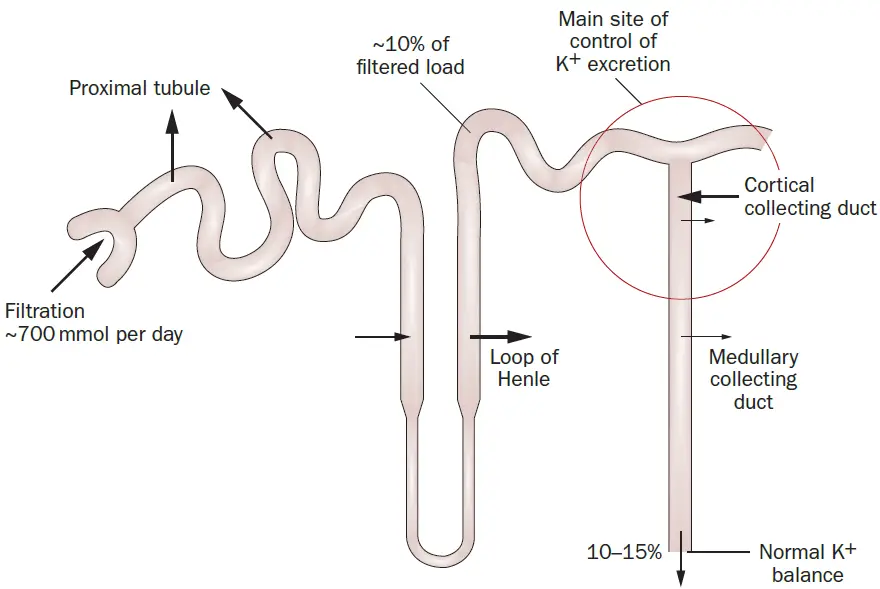
- Segmentos Principales del Nefrón: Incluyen el túbulo proximal, el asa de Henle con sus ramas delgada y gruesa, el túbulo distal, y el conducto colector (túbulo conector, conducto colector cortical y conducto colector medular).
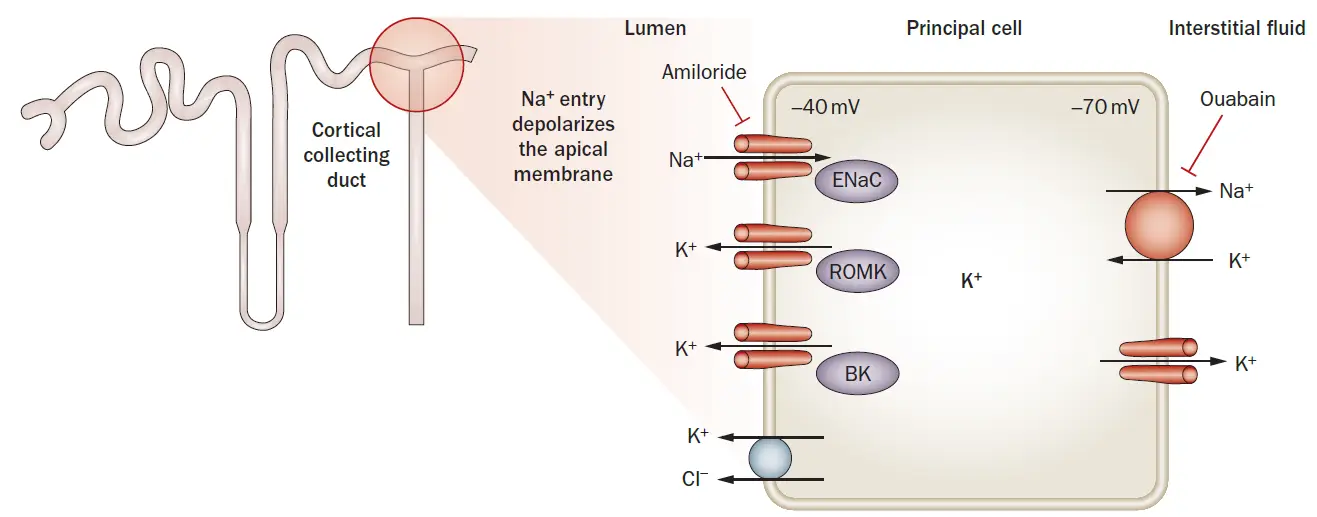
- Conducto Colector: Consiste en dos tipos de células:
- Células Principales: Reabsorben sodio (Na+) y secretan K+ bajo el efecto de la aldosterona.
- Células Intercaladas: Mantienen el equilibrio ácido-base. El número de células intercaladas disminuye a medida que el conducto colector se dirige hacia la médula.
- Manejo de Potasio en el Nefrón:
- El K+ filtrado a través del glomérulo es casi completamente absorbido antes de llegar al conducto colector.
- Alrededor del 65% se absorbe en el túbulo proximal y el 25% en el asa de Henle.
- El 10% del K+ filtrado alcanza el túbulo contorneado distal temprano.
- Importante: Casi todo el K+ en la orina es secretado por el conducto colector.
- Existen varios tipos de canales de K+ en el riñón y otros órganos. En el conducto colector cortical se encuentran dos tipos de canales de K+:
- Canal de Potasio de la Médula Externa Renal (ROMK): Es el principal canal secretor de K+ y es activado por la aldosterona. Se localiza en la célula principal del conducto colector. Bajo estados fisiológicos, tiene una alta probabilidad de estar abierto.
- Canal Maxi-K+ (Canal BK): Es activado por altas tasas de flujo a través del conducto colector. Los canales Maxi-K+ se localizan tanto en las células principales como en las intercaladas del conducto colector.
- 4 factores principales determinan la secreción de K+ en el conducto colector:
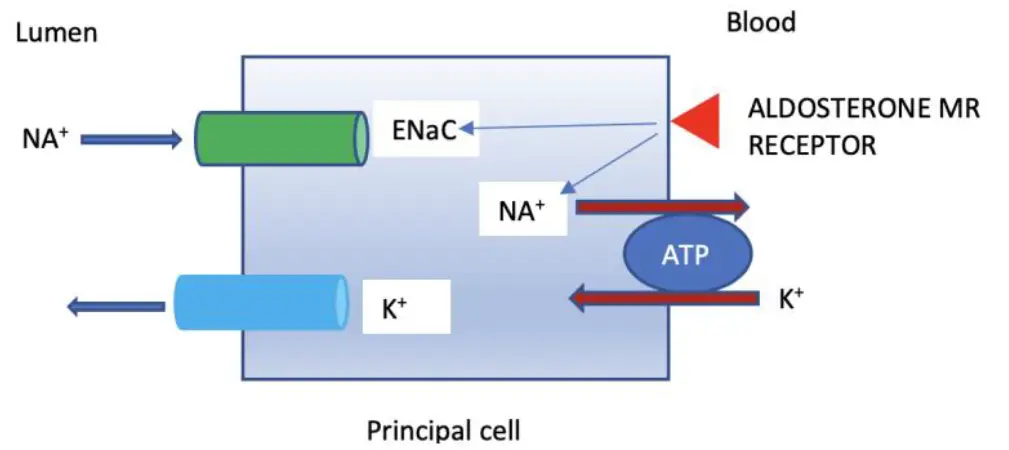
- Aldosterona:
- Secretada por la zona glomerulada de la corteza adrenal.
- Determinante principal de la secreción de K+.
- Aumenta la absorción de Na+ y la excreción de K+ a través de la activación de la bomba Na+-K+-ATPasa y el incremento del número de canales de K+ abiertos.
- La bomba Na+-K+-ATPasa se encuentra en la membrana basolateral de la célula principal y existe en casi todas las células vivas.
- La aldosterona también activa el canal de sodio epitelial (ENaC) o Canal de Sodio Sensible a Amilorida en la membrana apical de las células principales del conducto colector, donde la absorción de Na+ genera una carga negativa que estimula la secreción de K+ a través del canal ROMK.
- Tasa de flujo distal:
- Una disminución en la tasa de flujo distal disminuirá la secreción de K+ en el conducto colector.
- Lo contrario es cierto; un aumento en la tasa de flujo distal (por ejemplo, debido al uso de diuréticos) aumentará la secreción de K+ en el conducto colector.
- Como se mencionó anteriormente, una alta tasa de flujo activa el canal Maxi-K (BK).
- Potasio sérico:
- Un aumento en el K+ sérico incrementará directamente la secreción de aldosterona desde la zona glomerulada, y lo contrario también es cierto.
- Entrega de aniones al conducto colector:
- Los aniones aumentan la negatividad del lumen y la excreción de K+.
- Ejemplos incluyen el bicarbonato en alcalosis metabólica y aniones no absorbibles como la nafcillina.
- Los aniones aumentan la negatividad del lumen y la excreción de K+.
- Aldosterona:
La "Paradoja de la Aldosterona"
- La aldosterona mejora la absorción de Na+ y la secreción de K+ en el conducto colector.
- En casos de hipovolemia, la reabsorción de Na +es deseable, pero una excreción concomitante de K+ no lo es, ya que llevaría a hipoK.
- Aplicando la misma lógica a la hiperK, aumentar la excreción de K+ es deseable, pero no la reabsorción de Na+, ya que llevaría a hipervolemia.
- La «Paradoja de la Aldosterona» se refiere al hecho de que en hipovolemia, la aldosterona aumenta la absorción de Na+ sin perdida de K+. Además, en hiperK, la aldosterona mejora la excreción de K+ en el conducto colector sin aumentar la absorción neta de Na+.
Etiología
📌 Pseudohipokalemia
- Se observa cuando las muestras de sangre que contienen un número muy alto de glóbulos blancos (>75 x 10^9/L) se almacenan a temperatura ambiente.
- La hipoK es el resultado de la captación de K+ por los glóbulos blancos.
- Esto se ve en la leucemia mieloide aguda (LMA).
- Medir el K+ después de una rápida separación del plasma previene este error.
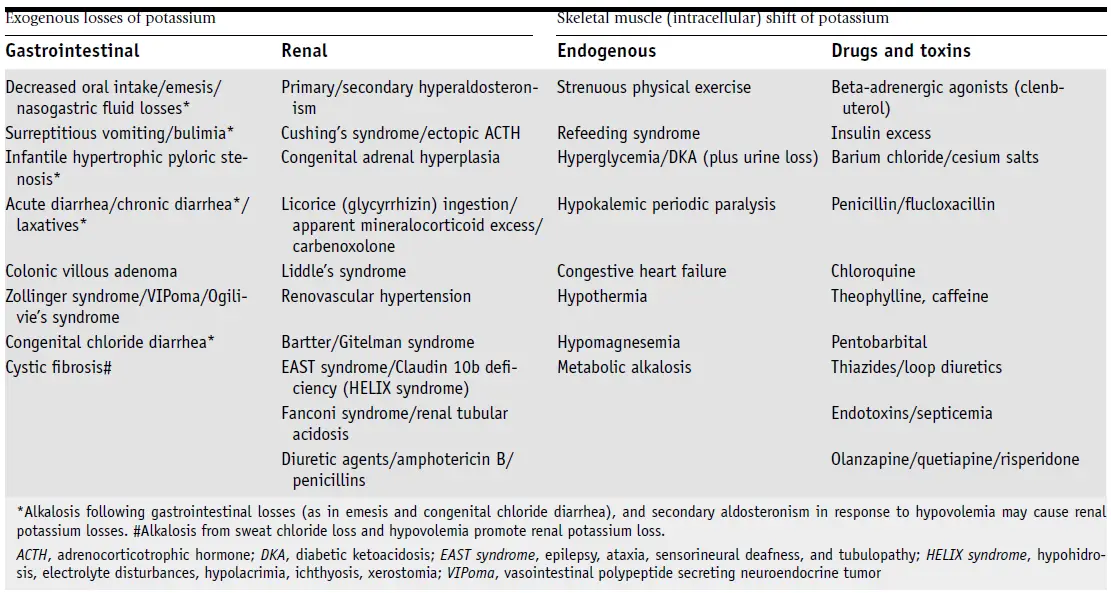
📌 Desplazamiento o redistribución del potasio intracelular
- La insulina y los agonistas de los receptores β2 (como la epinefrina, el albuterol y la efedrina) son las principales causas del desplazamiento intracelular de K+.
- Esta redistribución se observa en la parálisis periódica hipokalemica.
- Se trata de un trastorno raro que se ve más comúnmente en asiáticos en asociación con tirotoxicosis.
- Otras causas raras son intoxicaciones con verapamilo, sales de cesio, cloroquina o bario.
- Los medicamentos antipsicóticos como la risperidona y la quetiapina pueden raramente causar un desplazamiento intracelular de K+.
📌 Perdidas no renales de potasio
- Las causas más comunes de hipoK en esta categoría están relacionadas con el tracto gastrointestinal, como la diarrea, el vómito, la succión nasogástrica (NG) y los laxantes.
- La hipoK debido a la pérdida de K+ a través de la sudoración excesiva es poco común.
- Es importante señalar que las condiciones mencionadas están asociadas con deshidratación, lo que conduce a hiperaldosteronismo secundario y pérdida renal de K+.
- En el vómito y la succión NG, la hipoK resulta de hiperaldosteronismo secundario (debido a la deshidratación) y alcalosis metabólica (debido a la pérdida de cloruro). La concentración de K+ en el jugo gástrico es pequeña (alrededor de 8 mmol/l).
- La pérdida directa de K+ es importante en la diarrea porque la concentración de K+ en las heces es de 80-90 mmol/l.
- La alcalosis metabólica se asocia con hipoK debido al desplazamiento intracelular de K+, excreción renal de K+ debido a la bicarbonaturia e hiperaldosteronismo secundario (cuando hay depleción de volumen).
- La hemodiálisis y la diálisis peritoneal son causas comunes de hipoK en pacientes sometidos a terapia de reemplazo renal.
📌 Perdidas renales de potasio
- La pérdida renal de K+ es la etiología más común de hipoK. Esta categoría incluye medicamentos, hormonas, hipomagnesemia y acidosis tubular renal.
- Diuréticos: Tales como tiazidas y diuréticos de asa son una causa común debido al aumento del flujo distal y al hiperaldosteronismo secundario resultante de la depleción de volumen.
- Combinar dos diuréticos, como metolazona y un diurético de asa, o acetazolamida y un diurético de asa, puede llevar a una hipoK severa.
- Antibióticos: Varios antibióticos pueden causar hipoK debido a una variedad de mecanismos.
- Dosis altas de penicilina G y análogos de penicilina pueden causar hipoK debido a la entrega en el túbulo distal de aniones no reabsorbibles que aumentan la excreción de K+.
- Aldosterona: Es la principal hormona reguladora de K+, y un exceso de aldosterona, como en el aldosteronismo primario, lleva a hipoK.
- Deficiencia de Magnesio: Puede resultar en una hipoK refractaria.
- El magnesio inhibe los canales ROMK; consecuentemente, la hipomagnesemia aumenta la secreción de potasio en el conducto colector.
- Acidosis Tubular Renal: Tanto la acidosis tubular renal proximal como distal causan hipoK debido a la pérdida renal de K+.
- Trastornos Raros: La pérdida renal de K+ también se observa en ciertos trastornos raros como el síndrome de Bartter, el síndrome de Gitelman y el síndrome de Liddle.
- Reabsorción de Sodio y ENaC: La reabsorción de sodio debido a la hiperactividad de ENaC (mutación de ganancia de función) aumenta la carga negativa en el lumen del conducto colector, lo que mejora la excreción de K+.
- Este es el mecanismo de hipoK en el síndrome de Liddle, un trastorno autosómico dominante y una causa rara de hipertensión caracterizada por el inicio temprano de HTA, renina y aldosterona suprimidas, hipoK y alcalosis metabólica.
- Se trata con amilorida o triamtereno, que bloquean ENaC.
- Los tiazídicos agravan la pérdida de K+.
- Diuréticos: Tales como tiazidas y diuréticos de asa son una causa común debido al aumento del flujo distal y al hiperaldosteronismo secundario resultante de la depleción de volumen.
Signos y sintomas
- La hipoK leve puede ser asintomática.
- La mayoría de los pacientes sintomáticos tienen un K+ sérico <3 mmol/l.
- La gravedad de los síntomas también está relacionada con la velocidad de disminución de K+.
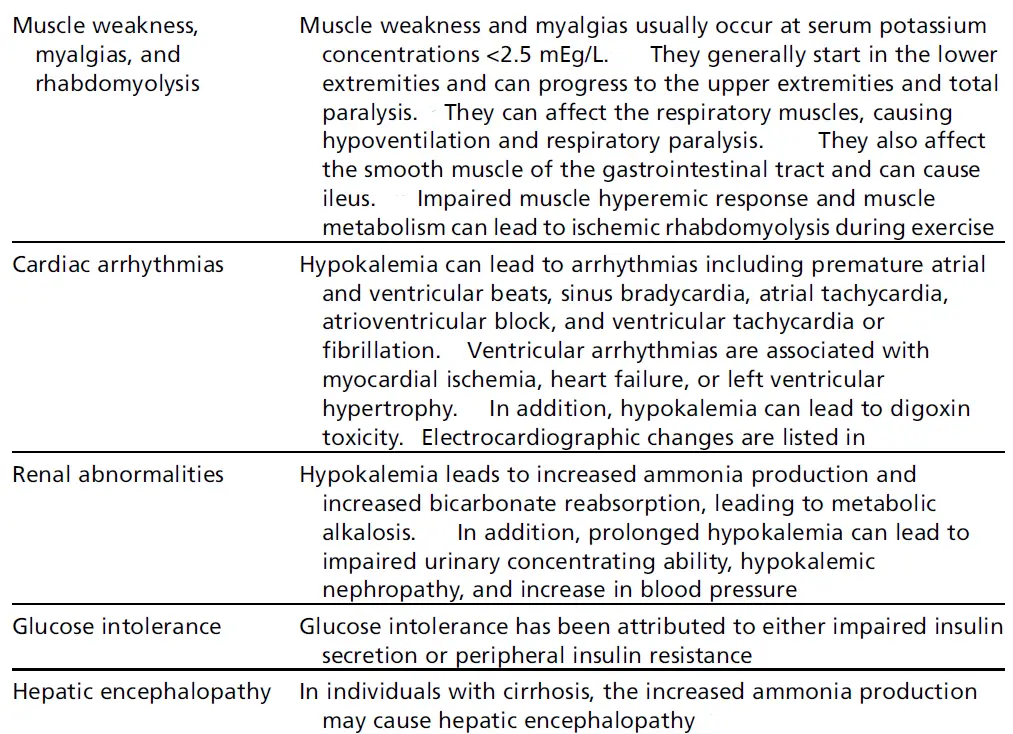
- Síntomas Comunes: La debilidad muscular y la fatiga son los síntomas más comunes al presentarse.
- Tanto la hipoK como la hiperK pueden resultar en debilidad muscular, comenzando en las extremidades inferiores y ascendiendo al tronco y extremidades superiores.
- Hipokalemia Severa:
- La debilidad muscular puede progresar a parálisis flácida, aunque esto es raro. Algunos pacientes desarrollan calambres musculares.
- La hipoK severa puede llevar a rabdomiólisis.
- Síntomas Gastrointestinales: íleo, náuseas, vómitos y constipación.
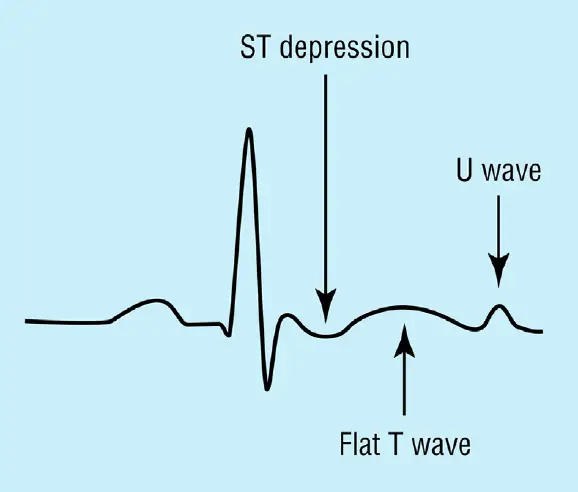
- Cambios en el ECG:
- Ondas T planas
- Depresión del segmento ST
- Ondas U prominentes.
- Puede resultar en palpitaciones además de taquiarritmias ventriculares y supraventriculares.
- Los digitálicos aumentan la probabilidad de arritmias.
- Manifestaciones Renales: Poliuria, polidipsia y diabetes insípida nefrogénica (DI).
- La hipoK crónica puede raramente resultar en nefritis tubulointersticial crónica (NIC).
- Manifestaciones metabólicas: Intolerancia a la glucosa debido a una disminución en la secreción de insulina.
- Manifestaciones del sistema nervioso central: Psicosis, delirio, alucinaciones y depresión.
Diagnostico
- Identificación de la causa subyacente: La causa de la hipoK suele ser evidente tras una historia médica detallada y un examen físico.
- Evaluación de la severidad y tratamiento: Necesario evaluar los niveles de sK+ y urinario para iniciar un tratamiento adecuado.
- Pruebas endocrinas: Apropiadas dependiendo de los hallazgos anteriores, pero no como pruebas de primera línea a menos que haya un alto índice de sospecha clínica.
- Panel básico de laboratorio bioquímico: Incluye sodio, potasio, glucosa, cloruro, bicarbonato, BUN y creatinina, esencial para el tamizaje en pacientes con hipoK.
- Electrolitos urinarios: Útiles para diferenciar entre causas renales y no renales de hipoK.
- Gases arteriales: Para detectar acidosis o alcalosis metabólica cuando la causa no es clara por la historia.
- Medición de K+ en sangre venosa: Adecuada en el servicio de emergencias, dado que no hay diferencia clínica significativa con la sangre arterial.
- Análisis de orina y medición del pH: Para evaluar la presencia de acidosis tubular renal.
- Niveles de magnesio, calcio y fósforo séricos: Importantes para excluir anomalías electrolíticas asociadas, especialmente en casos de sospecha de alcoholismo.
- Excreción de calcio urinario: Crítica para excluir el síndrome de Bartter.
- Medición de digoxina en suero: Si el paciente está siendo tratado con digital.
- Pruebas de drogas: En orina y/o suero para diuréticos, anfetaminas y otros estimulantes simpaticomiméticos en casos de alta sospecha clínica.
- Evaluación de niveles de TSH: Requerida en casos de taquicardia o sospecha clínica de parálisis periódica hipokalemica.
- Componentes de la evaluación diagnóstica: Incluye la evaluación de la excreción de potasio urinario para distinguir pérdidas de potasio renal de otras causas y la evaluación del estado ácido-base.
Valoración de la excreción del potasio urinario
- La medición de la excreción de K+ en orina de 24 horas es el mejor método para evaluar la excreción urinaria de K+.
- Si la excreción supera los 15 mEq de K+ por día, indica una pérdida renal inapropiada de K+.
- Si no es factible recolectar orina durante 24 horas, se puede medir las concentraciones de K+ y creatinina en una muestra puntual de orina.
- Una relación potasio-creatinina en orina puntual >13 mEq/g (1.5 mEq/mmol) usualmente indica una pérdida renal inapropiada de K+.
- Tras determinar la presencia de perdidas renales de K+, la evaluación del estado ácido-base puede ayudar a precisar el diagnóstico diferencial.
Valoración del estado acido-base
- Una vez que se ha medido la excreción urinaria de K+, se deben considerar las siguientes posibilidades diagnósticas en un paciente con hipoK de origen incierto:
- Acidosis metabólica con baja excreción de K+: En un paciente asintomático, es sugerente de pérdidas gastrointestinales bajas debido al abuso de laxantes o un adenoma velloso.
- Cetoacidosis diabética y acidosis tubular renal: Tanto el tipo 1 (distal) como el tipo 2 (proximal) pueden ocurrir debido a una acidosis metabólica con pérdida de K+ urinario.
- Vómitos subrepticios: Comunes en pacientes bulímicos que intentan perder peso, o el uso de diuréticos puede ser la causa de una alcalosis metabólica con baja tasa de excreción de K+ urinario.
- Abuso de laxantes con alcalosis metabólica: Algunos pacientes presentan alcalosis metabólica en lugar de la esperada acidosis metabólica.
- Por otro lado, cuando hay una alcalosis metabólica con pérdida de K+ urinario y el paciente tiene una presión arterial normal, el diagnóstico incluye:
- Uso de diuréticos, vómitos, síndrome de Gitelman o de Bartter: En este contexto, la medición de la concentración de cloruro en la orina es a menudo útil, siendo normal (igual a la ingesta) en los síndromes de Gitelman o Bartter.
- Concentración de cloruro en la orina alta o baja con diuréticos: Dependiendo de la duración de acción del diurético. En casos de vómitos, esta concentración es baja cuando la excreción de Na+ y K+ urinario puede ser relativamente alta.
- Hipertensión y diurético subrepticio: Primero en el diagnóstico diferencial en un paciente con hipertensión subyacente, enfermedad renovascular o una de las causas de exceso mineralocorticoide primario.
- Además, pacientes con síndrome de Bartter o Gitelman pueden presentar:
- Constipación, calambres musculares y debilidad: Mareos no específicos y fatiga.
- Las características bioquímicas de ambos síndromes pueden incluir alcalosis metabólica hipoK e hipoclorémica asociada con alta actividad de renina plasmática y alta concentración de aldosterona.
- Síndrome de Bartter: Presentación en la primera infancia con fallas en el crecimiento más severas y considerable retraso del crecimiento. El síndrome de Gitelman está asociado con una falla menos severa en el crecimiento y un retraso del crecimiento más leve.
- Síndrome de Liddle: Una forma rara de hipertensión autosómica dominante con penetrancia temprana y secuelas cardiovasculares importantes. A pesar de la presentación clínica típica del aldosteronismo primario, las tasas reales de excreción de aldosterona están notablemente suprimidas.
- Constipación, calambres musculares y debilidad: Mareos no específicos y fatiga.
Causas endocrinas de hipokalemia
- Tamizaje para aldosteronismo primario (AP): Recomendado en casos de hipoK espontánea o inducida por diuréticos e hipertensión.
- Evaluación de la ARP: Se debe medir la relación aldosterona plasmática a actividad de renina plasmática (ARP). Una ARP >20 sugiere un diagnóstico directo de AP sin necesidad de pruebas confirmatorias adicionales.
- Pacientes de alto riesgo para hiperaldosteronismo primario: Incluye aquellos con hipertensión en etapa I o II, hipertensión resistente a medicamentos, hipertensión con incidentaloma adrenal o historia familiar de hipertensión temprana o accidente cerebrovascular antes de los 40 años.
- Tomografía computarizada adrenal: Recomendada para todos los pacientes con AP para excluir grandes masas y posible carcinoma adrenocortical.
- Muestreo venoso adrenal: Sugerido por radiólogos experimentados para diferenciar entre enfermedad adrenal unilateral y bilateral, especialmente si el tratamiento quirúrgico es una opción.
- Pruebas genéticas para GRA: Indicadas en pacientes jóvenes con AP confirmado antes de los 20 años o con antecedentes familiares de AP o accidentes cerebrovasculares a una edad temprana.
- Diagnóstico de hiperaldosteronismo familiar tipo 3: Recomendado probar mutaciones germinales en KCNJ5 en pacientes muy jóvenes con AP.
- Causas raras de hipertensión e hipoK: Incluyen deficiencia de 11-beta hidroxilasa y 17-alfa hidroxilasa, caracterizadas por la producción aumentada de precursores de cortisol y aldosterona.
- Diagnóstico diferencial en hipercortisolismo: Se recomienda confirmar la producción autónoma de cortisol mediante pruebas como cortisol urinario de 24h, cortisol salival nocturno, y pruebas de supresión con dexametasona si hay características clínicas de hipercortisolismo y se ha excluido el uso de corticosteroides exógenos.
Aparente exceso de mineralocorticoides (AEM)
- Es una enfermedad autosómica recesiva causada por la deficiencia de la enzima 11beta-hidroxiesteroide deshidrogenasa tipo 2 (11beta-HSD2) (45).
- La 11beta-HSD2 convierte el cortisol en cortisona inactiva y previene la estimulación del receptor mineralocorticoide por el cortisol.
- Hay una mejor estimulación de los receptores mineralocorticoides por el cortisol en el nefrón distal causando una elevada reabsorción de Na+ y un aumento en la excreción de K+.
- La retención de sodio conduce a una hipertensión severa de renina baja.
- Diagnóstico: Detección de una concentración aumentada de metabolitos de cortisol y una concentración baja o indetectable de metabolitos de cortisona en orina.
- El análisis molecular del gen HSD11B2 confirma el diagnóstico.
- Tratamiento: Diuréticos ahorradores de K+, a veces en combinación con diuréticos de asa (furosemida).
- Las formas leves de AEM podrían ocurrir más frecuentemente de lo que se conoce actualmente y se debe sospechar en pacientes con hipertensión, hipoK y disminución de la concentración de renina plasmática.
Pruebas adicionales
📌 Imagenes
- Imágenes de las glándulas adrenales: Se recomienda realizar una tomografía computarizada (TC) o resonancia magnética (RM) si hay sospecha de exceso de mineralocorticoides, glucocorticoides, o catecolaminas.
- RM de la glándula pituitaria: Útil para descartar la enfermedad de Cushing como parte del estudio de la hipoK.
- TC abdominal: Debe realizarse si se presentan características clínicas y de laboratorio de un VIPoma, que incluyen:
- Diarrea acuosa persistente aun con ayuno, con heces de color té y sin olor y volúmenes que superan los 700 mL/día.
- Dolor abdominal leve o ausente.
- Episodios de enrojecimiento y letargo.
- Náuseas, vómitos, debilidad muscular y calambres musculares, relacionados con hipoK y deshidratación (presente en el 20% de los pacientes).
- Escintigrafía con pentetreótido radiomarcado o ecografía endoscópica: Pueden ser necesarias si la TC abdominal es inconclusa para confirmar el diagnóstico de VIPoma.
📌 Electrocardiograma
- Se recomienda realizar un ECG a TODOS los pacientes con hipoK.
- Típicamente, se observa supresión del segmento ST, disminución en la amplitud de la onda T y un aumento en la amplitud de las ondas U (a menudo visto en las derivaciones precordiales laterales V4 a V6).
- Una variedad de arritmias puede estar asociadas con la hipoK, incluyendo bradicardia sinusal, latidos prematuros auriculares y ventriculares, taquicardia auricular o de unión paroxística, bloqueo atrioventricular, taquicardia ventricular o fibrilación.
Tratamiento
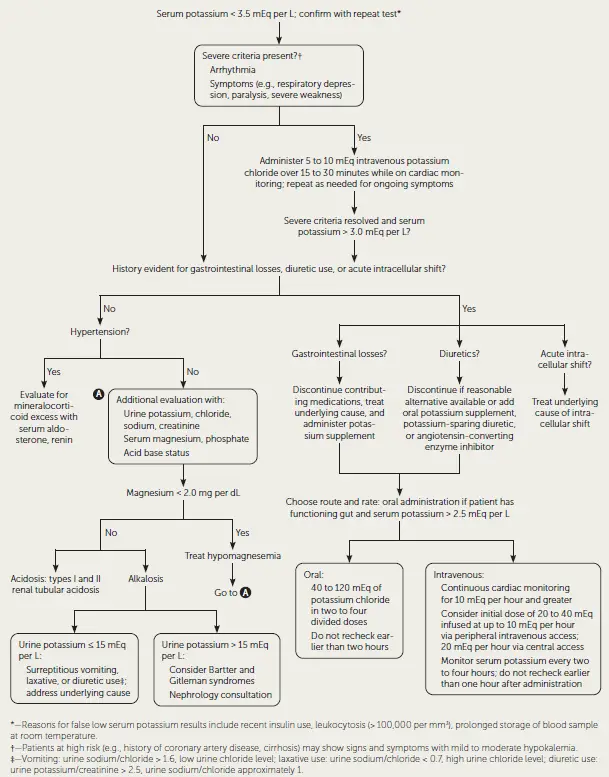
- Los pacientes con niveles de sK+ en el rango de 3.0-3.5 mmol/l generalmente son tratados con sales de K+ orales, siempre y cuando puedan tomar medicamentos orales.
- Los pacientes con sK+ < 3 mmol/l pueden requerir K+ intravenoso (IV), especialmente en situaciones de emergencia como arritmias, rabdomiólisis e insuficiencia respiratoria.
- En muchas situaciones, se utilizan tanto sales de K+ orales (VO) como intravenosas (IV).
- La reposición IV de K+ es apropiada para pacientes con cambios en el ECG y en casos de hipoK asociada con cetoacidosis diabética (CAD) o el uso de digital.
- El déficit de K+ es de aproximadamente 200-400 mEq por cada caída de 1 mEq/l en K+, pero la cantidad real varía entre individuos.
- La mayoría de los pacientes son tratados con cloruro de potasio (KCl).
- El KCl está ampliamente disponible en múltiples formas (tabletas de liberación extendida (LE), cápsulas, líquido e IV).
- El KCl actúa rápidamente y es el agente preferido, especialmente en pacientes con alcalosis metabólica concomitante.
- En esos pacientes, la reposición de Cl- es de suma importancia.
- El Cl- permanece mayormente en el compartimento extracelular.
- Si se administra bicarbonato de potasio, el HCO3- entra principalmente en la célula y el K+ lo sigue, lo que hace que el bicarbonato de potasio (y el citrato/acetato, que son precursores del bicarbonato) sea menos efectivos.
- El KCl por vía IV debe administrarse a una tasa que no exceda los 10 mEq/h.
- En situaciones de emergencia, como arritmias cardíacas, se puede considerar una tasa más alta de hasta 20 mEq/h, pero se requiere monitoreo continuo.
- Debe realizarse a través de un catéter venoso central si está disponible.
- Puede causar flebitis y muchos pacientes encuentran la infusión dolorosa.
- Es preferible administrar KCl por vía IV en solución salina al 0.9% (generalmente 20 mEq de KCl en 100 ml de NaCl al 0.9%).
- Administrar KCl por vía IV en una solución de dextrosa puede estimular la liberación de insulina y potencialmente agravar la hipoK.
- Los sustitutos de la sal de cloruro de potasio son una buena fuente de K+ oral.
- Contienen aproximadamente 13.6 mEq/g.
- Los alimentos que contienen K+ son apropiados para el manejo crónico de la hipoK leve.
- No son efectivos para el tratamiento de emergencia porque la cantidad necesaria para la corrección es grande, y el potasio en la dieta es K+ citrato o fosfato, que es menos efectivo en comparación con el KCl.
- Los plátanos son una buena fuente de K+.
- Contienen aproximadamente 1 mEq/cm.
- Se necesitan comer 2 plátanos grandes para obtener 40 mEq de K+.
- Ejemplos de alimentos que son altos en K+ incluyen: frutas secas (dátiles, higos, ciruelas), espinacas, brócoli, kiwis, mangos, naranjas, tomates, aguacates, plátanos, leche, pasas y frijoles lima
- Los diuréticos ahorradores de potasio pueden ser apropiados para el manejo crónico de la hipoK, especialmente en pacientes que ya están tomando un diurético tiazídico o de asa.
- Antagonistas de los receptores de aldosterona (espironolactona y eplerenona) pueden ayudar en el manejo de pacientes con insuficiencia cardíaca avanzada y en pacientes con hipertensión resistente.
- Amilorida también es bien tolerado; bloquea el canal de sodio epitelial ENaC en el conducto colector.
- Triamtereno rara vez se asocia con cálculos renales, y se prefiere el uso de amilorida, eplerenona o espironolactona.
- Si la hipoK se debe al abuso de laxantes y diuréticos, estos deben suspenderse.
- El tratamiento sintomático de la diarrea y el vómito también es útil.
- Si el paciente necesita administración de bicarbonato y potasio IV, el potasio debe administrarse primero porque el bicarbonato provoca un desplazamiento intracelular del K+.
Conclusiones
- La hipoK es frecuente y generalmente limitada; sin embargo, esta alteración puede poner en peligro la vida del paciente.
- Comprender las bases de la distribución del K+ en el organismo es el primer paso en el diagnóstico de la hipoK.
- Los niveles de insulina, la actividad adrenérgica, la aldosterona, la actividad Na+,K+-ATPasa, el pH y la osmolalidad pueden modificar la distribución interna de los iones de K+.
- El aldosteronismo primerio es una causa poco reconocida de hipoK e hipertensión.
- Las pérdidas extrarrenales, como la diarrea o el exceso de sudoración, son generalmente (aunque no siempre) evidentes.
- Las pérdidas renales de iones K+ son a menudo un efecto adverso de la terapia.
- El éxito del tratamiento de la hipoK requiere que se establezca la causa primaria y se aborde el problema subyacente.