Introducción.
Los anticoagulantes son la piedra angular en el tratamiento de las complicaciones tromboembólicas de una gran variedad de patologías (Mozaffarian, 2016). Su uso ha venido en aumento debido al envejecimiento de la población, aumento en la incidencia de enfermedades crónicas y a los avances en la detección temprana, prevención y tratamiento de múltiples patologías (Huang, 2014; Alotaibi, 2016). En los Estados Unidos, aproximadamente 6 millones de personas son tratadas con anticoagulantes (Barnes, 2015) lo que aumenta el riesgo de sangrado, aumentando a su vez la morbilidad y mortalidad asociada a sus complicaciones hemorrágicas.
Desde 1930 que se empezó a investigar sobre la heparina (Mulloy, 2008), múltiples usos y nuevas moléculas se han venido descubriendo y ofreciéndose para una gran variedad de patologías. Estos medicamentos actúan de forma que alteran la fisiología normal de la cascada de coagulación, dando lugar a una disminución de la generación de trombina o una inhibición directa de la trombina. La principal complicación es la hemorragia, esta puede ser autolimitada o potencialmente mortal (Baugh, 2020). La mayoría de estos pacientes acuden a los servicios de urgencias para recibir atención debido a la presencia de dicha complicación.
La valoración y manejo de los pacientes con complicaciones hemorrágicas por anticoagulantes, o sin ella pero con necesidad de una intervención o procedimiento urgente/emergente, es compleja. Los médicos deben conocer los diferentes tipos de anticoagulantes y su mecanismo de acción; esto les ayudará a tomar mejores decisiones al momento de estabilizar al paciente, y de estar indicado, administrar un reversos especifico.
El objetivo de esta publicación es brindar herramientas de decisión y manejo desde el servicio de urgencias para con los pacientes que allí acuden con complicaciones hemorrágicas asociadas al uso de cualquier anticoagulante. Además, de aquellos que no tienen sangrado pero que necesitan de forma urgente/emergente ser llevados a un procedimiento o intervención quirúrgica.
Epidemiología.
- Entre 2013 y 2015, 17.6% de todos los pacientes que se presentaron al servicio de urgencias por complicaciones asociadas al uso de medicamentos, estaban relacionadas con los anticoagulantes.
- La mitad de estos pacientes terminaron hospitalizados (Shehab, 2016)
- Aproximadamente 228.600 consultas a los servicios de urgencias están relacionadas con el uso de anticoagulantes.
- El 80% están asociadas a sangrados asociados a estos medicamentos (Institute for Safe Medication Practices, 2017)
- Los anticoagulantes directos o DOACs, son preferidos por encima de la Warfarina, en un sinnúmero de patologías.
- En los últimos años, el número de pacientes tratados con DOACs se ha duplicado, pasando de 3 millones a 7.6 millones (Ziakas, 2018).
- Hay una mayor incidencia de sangrados graves asociados a los DOACs, aproximadamente 5 x 100 personas/año.
- En Italia, entre 2017 y 2021, se prescribieron aproximadamente 600.000 a 700.000 DOACs (Lavalle, 2022).
- La tasa de hemorragias intracraneales fue de 7.9% a 11.5%.
- El Dabigatrán se asoció a sangrados graves en mayor medida respecto a los otros DOACs.
- Los principales sangrados reportados de forma global fueron las epistaxis y los sangrados rectales.
- Para Colombia, los datos aún son inconclusos o quizá inexistentes.
- Entre 2019 y 2020, en el Hospital Militar Nueva Granada de la ciudad de Bogotá, mediante su clínica de anticoagulación (Gil, 2022), encontraron:
- 10.3% de eventos de sangrado asociados al uso de Warfarina.
- 1.6% de eventos de sangrado asociados al uso de DOACs.
- Entre 2019 y 2020, en el Hospital Militar Nueva Granada de la ciudad de Bogotá, mediante su clínica de anticoagulación (Gil, 2022), encontraron:
- Actualmente, se encuentra en recolección de información el registro nacional de sangrado por anticoagulantes en el servicio de urgencias (RECCANT-AR), en cabeza del servicio de cardiología y clínica de anticoagulación, adjunto el servicio de urgencias del Hospital Universitario Fundación Valle del Lili.
Cascada de la coagulación y anticoagulantes disponibles.
Define Pérez-Gómez (2007) la cascada de la coagulación como: “Todo proceso de trombosis tiene su origen en la alteración o rotura del endotelio vascular con salida, por una parte, del factor tisular, que inicia el proceso de la coagulación, y por otro, del colágeno y el factor de Von Willebrand, que inicia la adhesión y la activación de las plaquetas. El equilibrio homeostático entre factores trombóticos y hemorrágicos durante el tratamiento anticoagulante puede alterarse por una inhibición insuficiente de la coagulación (trombosis) o por la aparición de hemorragia debido a excesivo tratamiento antitrombótico”.
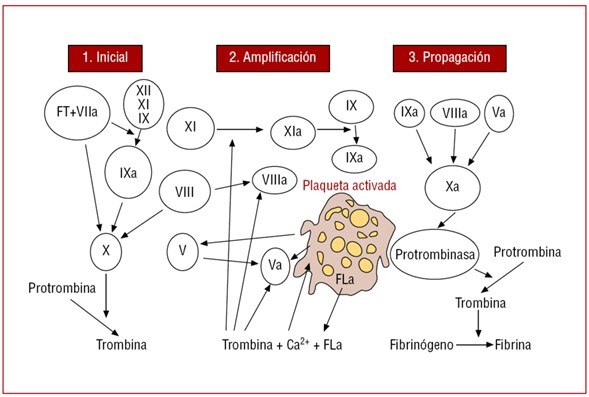
En 1964, MacFarlane (Abeyaratne, 1964) propuso el proceso de la coagulación tradicional, que ha sido de gran utilidad para el entendimiento del complejo problema en la formación de un trombo. Este autor proponía 2 vías, la vía extrínseca formada por el factor tisular y el factor VII; la vía intrínseca donde actuaban los factores XII, XI, IX, VIII y V. Ambas vías convergen en el factor X para continuar juntas el proceso de formación de la trombina; a partir de esta última, la fibrina. Mientras que el papel de las plaquetas para la agregación se consideraba un proceso independiente (Perez-Gomez, 2007).
Para 1994, los grupos investigadores de Houston (Schafer, 1994) y de Carolina del Norte (Monroe, 1994), proponen lo que denominan «la nueva cascada” (figura 1). Las características grandes de esta son (Perez-Gomez, 2007):
- El complejo formado por el factor tisular y el factor VII participan en la activación del factor IX, por lo que las dos vías de la coagulación, intrínseca y extrínseca, van unidas casi desde el inicio del proceso.
- El proceso completo no se realiza de forma continua, sino que son precisas tres fases consecutivas; inicial, de amplificación y de propagación. En las dos últimas participan activamente la plaqueta y la trombina.
- Fase inicial: El complejo factor tisular-factor VII, de forma directa e indirectamente a través del factor IX, activa inicialmente el factor X transformando pequeñas cantidades de protrombina en trombina, que son aún insuficientes para completar el proceso de formación de la fibrina.
- Fase de amplificación: La trombina así formada, junto con el calcio de la sangre y los fosfolípidos ácidos, que provienen de las plaquetas, participa activamente en un proceso de retroalimentación para la activación de los factores XI, IX, VIII y V y, de forma especial, para acelerar la activación de las plaquetas. Simultáneamente, por mecanismos quimiotácticos, los factores mencionados son atraídos a la superficie de las plaquetas donde tienen lugar de forma muy rápida importantes procesos de activación y multiplicación.
- Fase de propagación: La amplificación del proceso por mecanismos de retroalimentación entre trombina y plaqueta y la activación de todos estos factores permiten activar grandes cantidades del factor X y formar el complejo protrombinasa para convertir la protrombina en trombina y, a expensas de ésta, el fibrinógeno en fibrina. El proceso final, siempre en la superficie de la plaqueta, se acelera para generar de forma explosiva grandes cantidades de trombina y fibrina.
- Plaquetas: La activación de las plaquetas altera la permeabilidad de la membrana y permite la entrada de calcio y la salida de sustancias quimiotácticas, que atraen a los factores de la coagulación a su superficie. Al mismo tiempo se liberan factor V y fosfolípidos ácidos, que aportan el complemento necesario para el proceso de la coagulación.
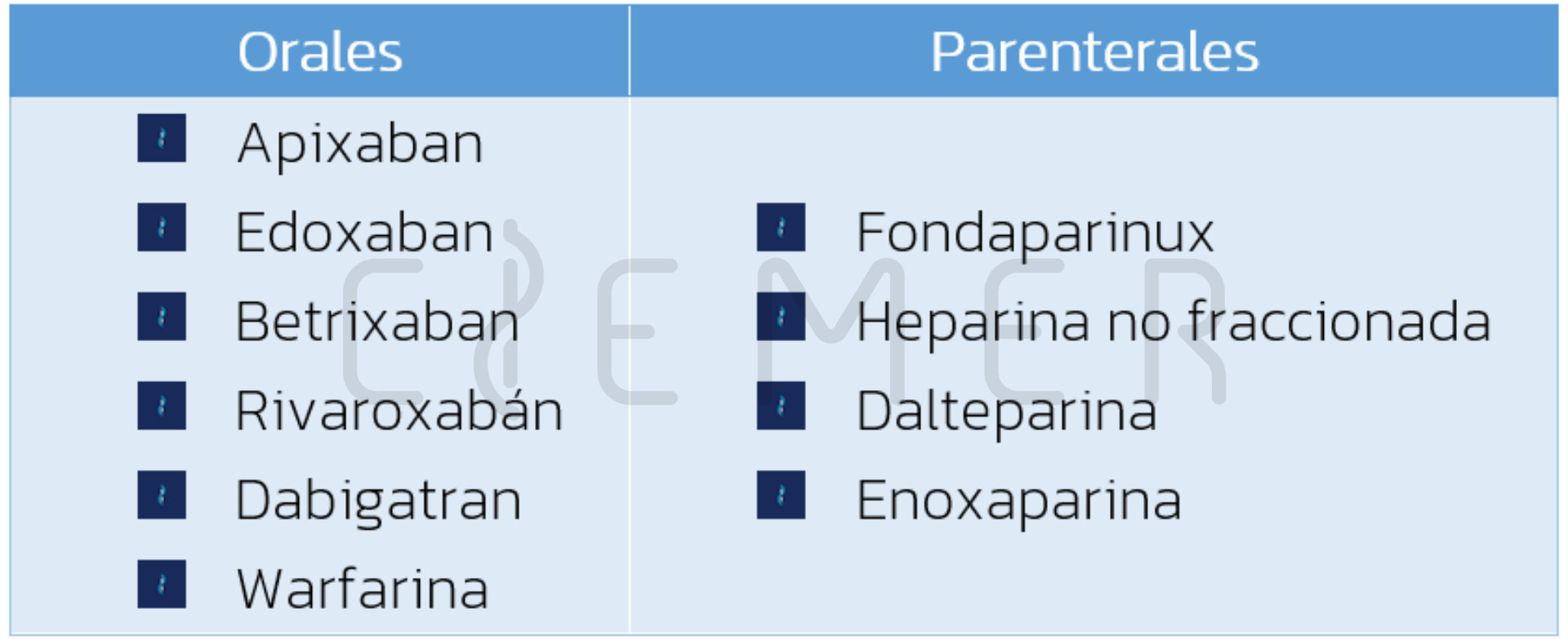
Actualmente, los anticoagulantes disponibles son (Baugh, 2020):
- Antagonistas de la Vitamina K: Actúan sobre los factores II, VII, IX y X. El exponente de este grupo es la Warfarina.
- Inhibidores del factor Xa: Apixaban, Betrixaban, Edoxaban y Rivaroxabán.
- Inhibidores directos de la trombina:
- Inhibidores del factor Xa mediados por antitrombina:
- Inhibidores indirectos del factor Xa y la trombina: Heparina no fraccionada, enoxaparina y dalteparina.
También los podemos subdividir según su vía de administración:
Valoración de la severidad del sangrado.
- La evaluación inicial en los pacientes con sangrado asociado al uso de anticoagulantes es un factor importante para la toma de decisiones de manejo para lograr la hemostasia y la adecuada función de los órganos.
- Puntos importantes: Historia clínica completa, examen físico minucioso, pruebas de laboratorio…
- El objetivo de todo lo anterior debe ser establecer el tiempo de inicio, localización, severidad del sangrado.
- Se deberá indagar sobre la hora de la administración de la última dosis del anticoagulante.
- Es importante determinar si hubo intento autolesivo con la administración del medicamento.
- Se debe determinar las patologías de base del pacientes, así como la ingesta de otros medicamentos.
- El examen físico debe ser repetido en varias ocasiones con el fin de anticiparse a la inestabilidad hemodinámica.
- Definición de la severidad del sangrado (Tomaselli, 2020):
- ≥1 de los siguientes factores se clasifica como sangrado grave:
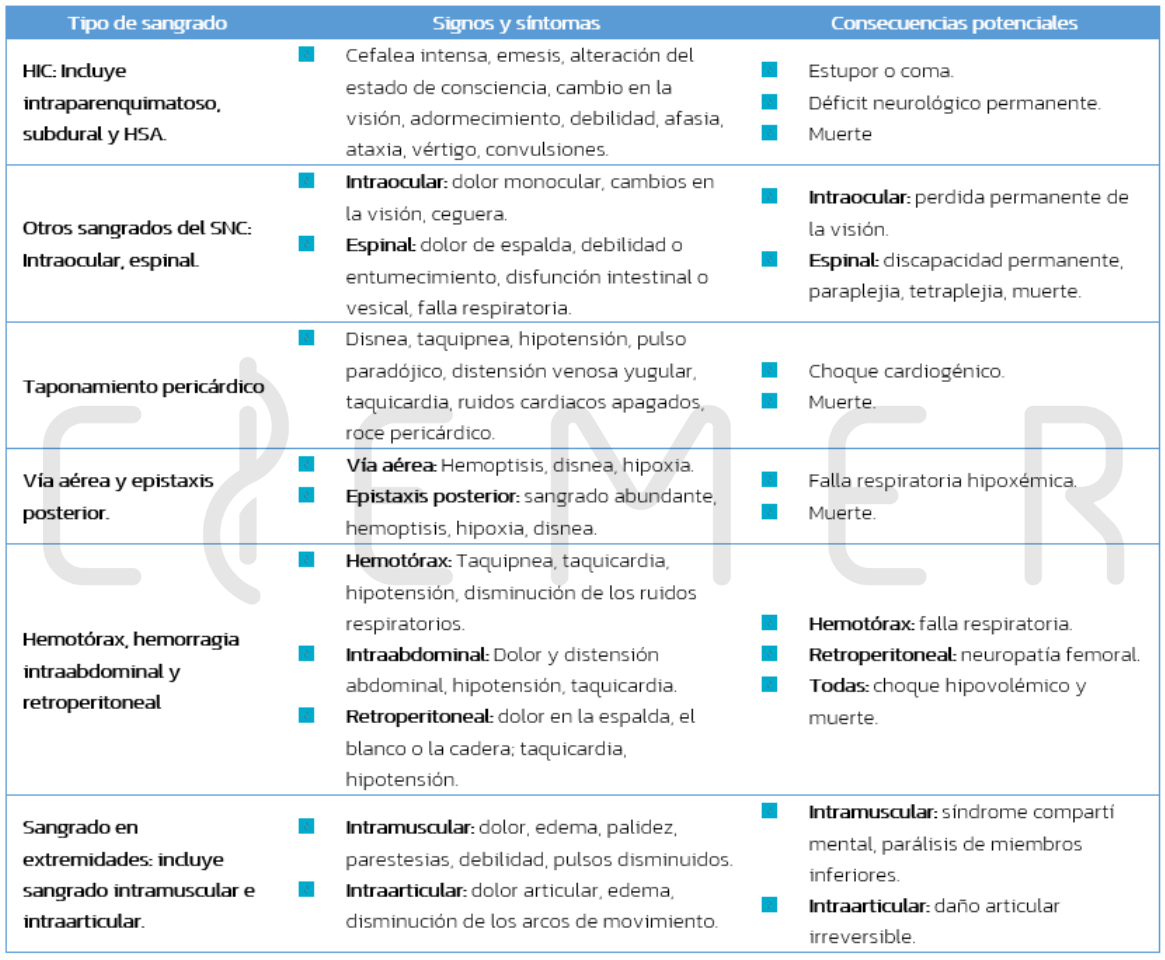
- Sangrado en sitio crítico:
- Intracerebral
- Intraocular con compromiso de la agudeza visual.
- Medula espinal.
- Pericárdico con signos de taponamiento.
- Vía aérea.
- Epistaxis posterior.
- Hemotórax.
- Intraabdominal.
- Retroperitoneal.
- Intramuscular.
- Intraarticular.
- Inestabilidad hemodinámica:
- TAS <90 mmHg
- Caída de la TAS >40 mmHg o cambios ortostáticos de la presión arterial (caída de la TAS ≥20 mmHg o disminución de la TAD de 10 mmHg estando de pie).
- TAM <65 mmHg medida con métodos invasivos.
- Marcadores subrogados de perfusión: Gasto urinario <0.5 ml/kg/h.
- Hemorragia manifiesta con descenso de ≥2 g/dl o administración de ≥2 unidades de glóbulos rojos.
- Las hemorragias que cumplen estos criterios se han asociado a mayor mortalidad.
- Pacientes con enfermedad cardiovascular de base, tienen una mayor probabilidad de muerte que los pacientes sin estas enfermedades con los descensos de hemoglobina.
- Sangrado en sitio crítico:
- ≥1 de los siguientes factores se clasifica como sangrado grave:
La valoración de la severidad del sangrado se hace respondiendo las siguientes preguntas para luego clasificarlo en grave y no grave:
¿El sangrado es un sitio critico?
¿Esta el paciente hemodinámicamente inestable?
¿Existe hemorragia clínicamente manifiesta con descenso de la hb ≥2 g/dl?
Sangrado Grave: Cualquier respuesta afirmativa (si) a las preguntas anteriores 1-3.
Sangrado no grave: Todas las respuesta negativas (no) a las preguntas anteriores 1-3.
Sitios críticos de sangrado.
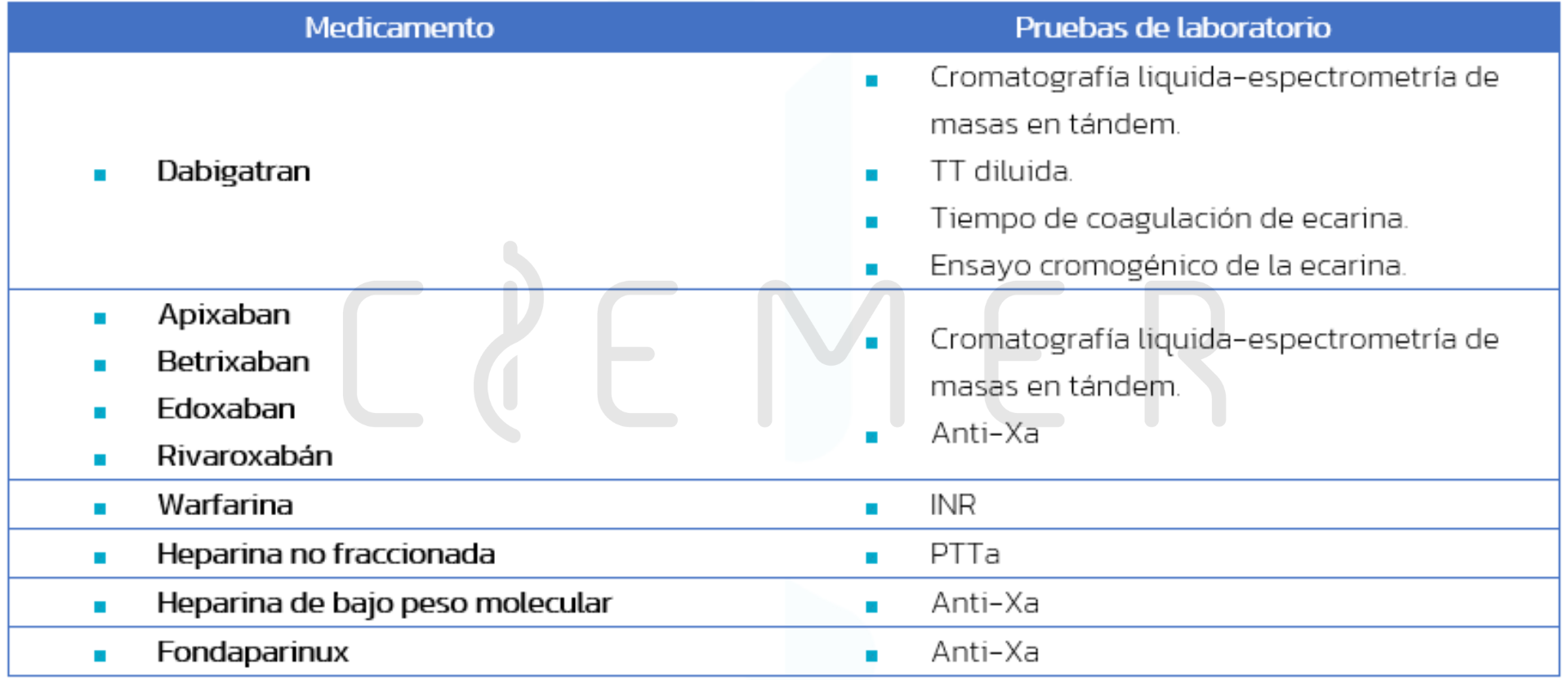
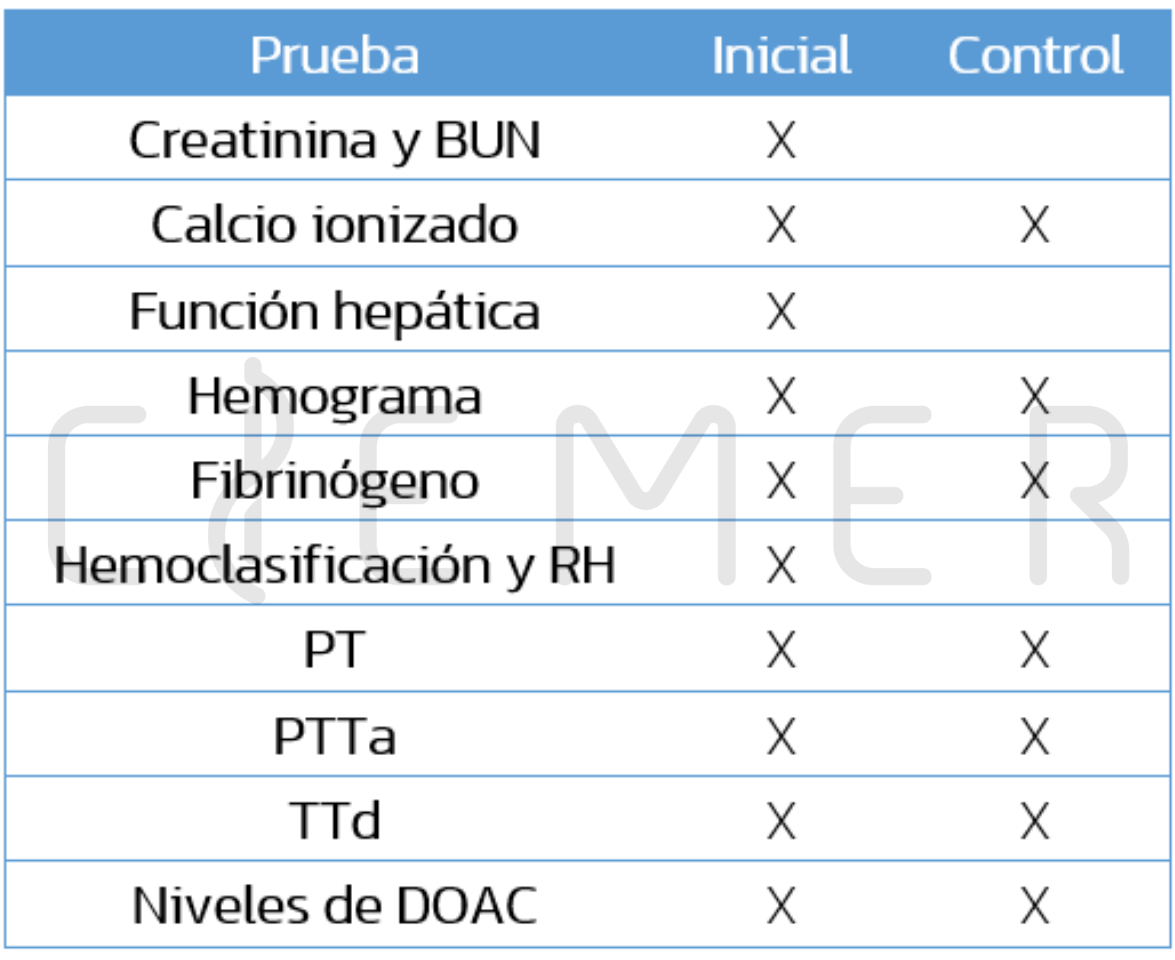
Pruebas de laboratorio.
Otras pruebas de laboratorio.
Manejo general del sangrado grave en urgencias.
- Valoración general del ABC.
- Control de la fuente de sangrado: Compresión directa, torniquete, cirugía, intervencionismo.
- Acceso intravenoso: 2 o más líneas periféricas 18G o mayores; acceso central en sitio compresible; acceso intraóseo si se anticipa transfusión.
- Laboratorios séricos.
- Líquidos intravenosos.
- Transfusión de hemocomponentes: Si se anticipa transfusión en el paciente los productos deben ser no cruzados; activación de protocolo de transfusión masiva de ser necesario.
- Optimizar las comorbilidades del paciente.
- Suspender anticoagulantes y antiagregantes plaquetarios.
- Uso de antídoto o reversor específico de estar disponible.
- Considerar la desmopresina si toma antiagregantes de forma concomitante.
- Acido tranexámico: Tópico o nebulizado en otorragia, epistaxis; intravenoso en sangrado traumático o ginecológico.
- La reanimación volumétrica agresiva debe hacerse con cristaloides como la solución salina al 0.9% o soluciones balanceadas (Baradarian, 2004; Spoerke, 2011).
- El objetivo debe ser la restauración de la estabilidad hemodinámica.
- Se debe corregir la acidosis y la hipotermia ya que pueden perpetuar la coagulopatía y empeorar el sangrado.
- Pacientes con anemia sintomática o sangrado activo, deben ser transfundidos con glóbulos rojos para mantener la hemoglobina ≥7 g/dl (Carson, 2016).
- La transfusión de plaquetas está indicada en conteos <50.000 (Razzaghi, 2012; Contreras, 1998).
- El crioprecipitado está indicado en niveles de fibrinógeno <100 mg/dl.
- Los pacientes politransfundidos o en los que se active protocolo de transfusión masiva, debe medirse los niveles de calcio ionizado sérico; si este se encuentra disminuido, se debe reponer.
Manejo general del sangrado NO grave en urgencias.
- Independiente de la severidad, se deberá implementar las medidas de control del sangrado.
- En estos casos no hay indicación de revertir con el antídoto la acción del medicamento.
- Se debe descontinuar el uso de los medicamentos anticoagulantes sopesando riesgo/beneficio.
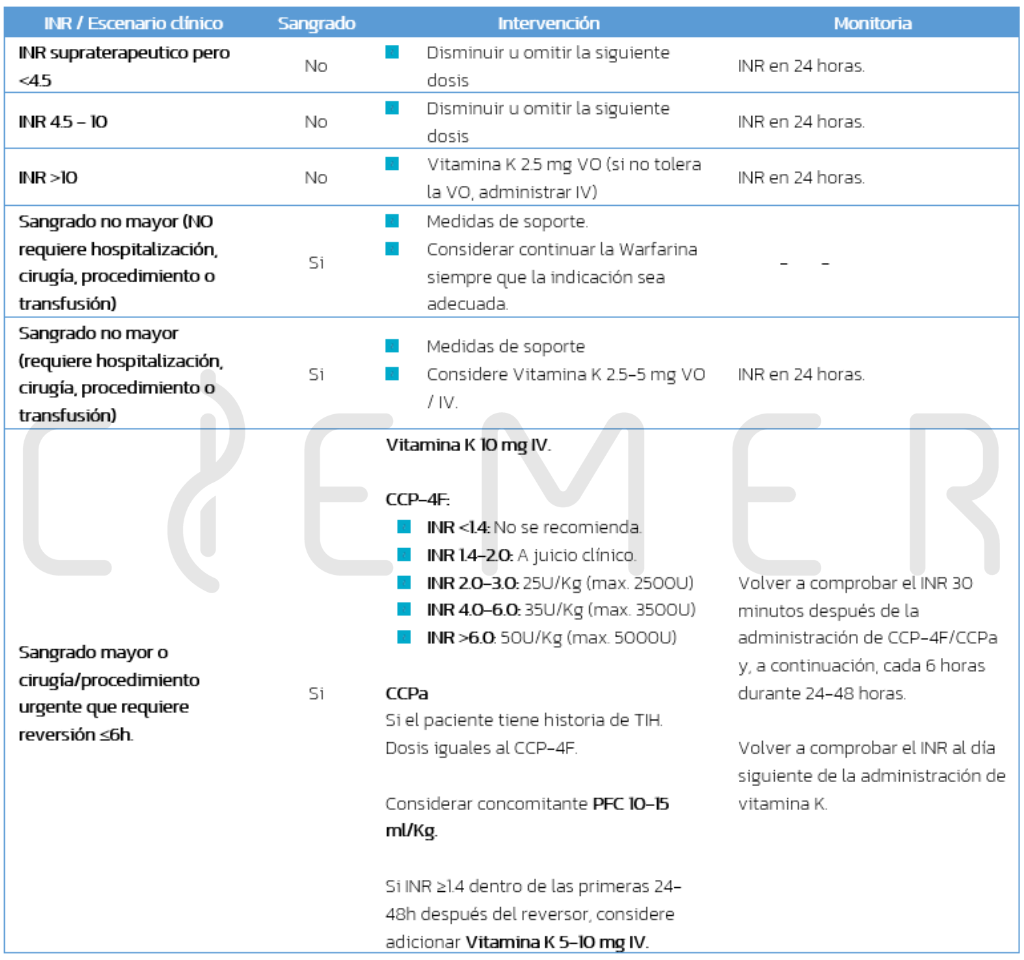
- ¿Está supra terapéutica la anticoagulación?
- ¿Está la anticoagulación en rangos terapéuticos?
- ¿Requiere un procedimiento invasivo pronto?
- ¿Ha cambiado el riesgo hemorrágico subyacente del paciente?
- ¿Está justificada una evaluación diagnóstica continuada para determinar el lugar o la repercusión clínica de la hemorragia?
- ¿Tiene el paciente de base una anemia severa que requiera transfusión de globulosa rojos >1 unidad?
- ¿Tiene el paciente comorbilidades médicas relevantes, fragilidad u otros problemas médicos activos que requieran observación y tratamiento?
- ¿Existe la preocupación de una hemorragia lenta en un lugar crítico que requiera repetir el diagnóstico por imagen?
- Si la respuesta a alguna de las preguntas anteriores Es afirmativa, se recomienda la suspensión del medicamento.
- Si se logró la hemostasia y el paciente no requirió estar hospitalizado, se recomienda reiniciar el manejo anticoagulante.
Estrategias de Reversión
Anticoagulantes orales:
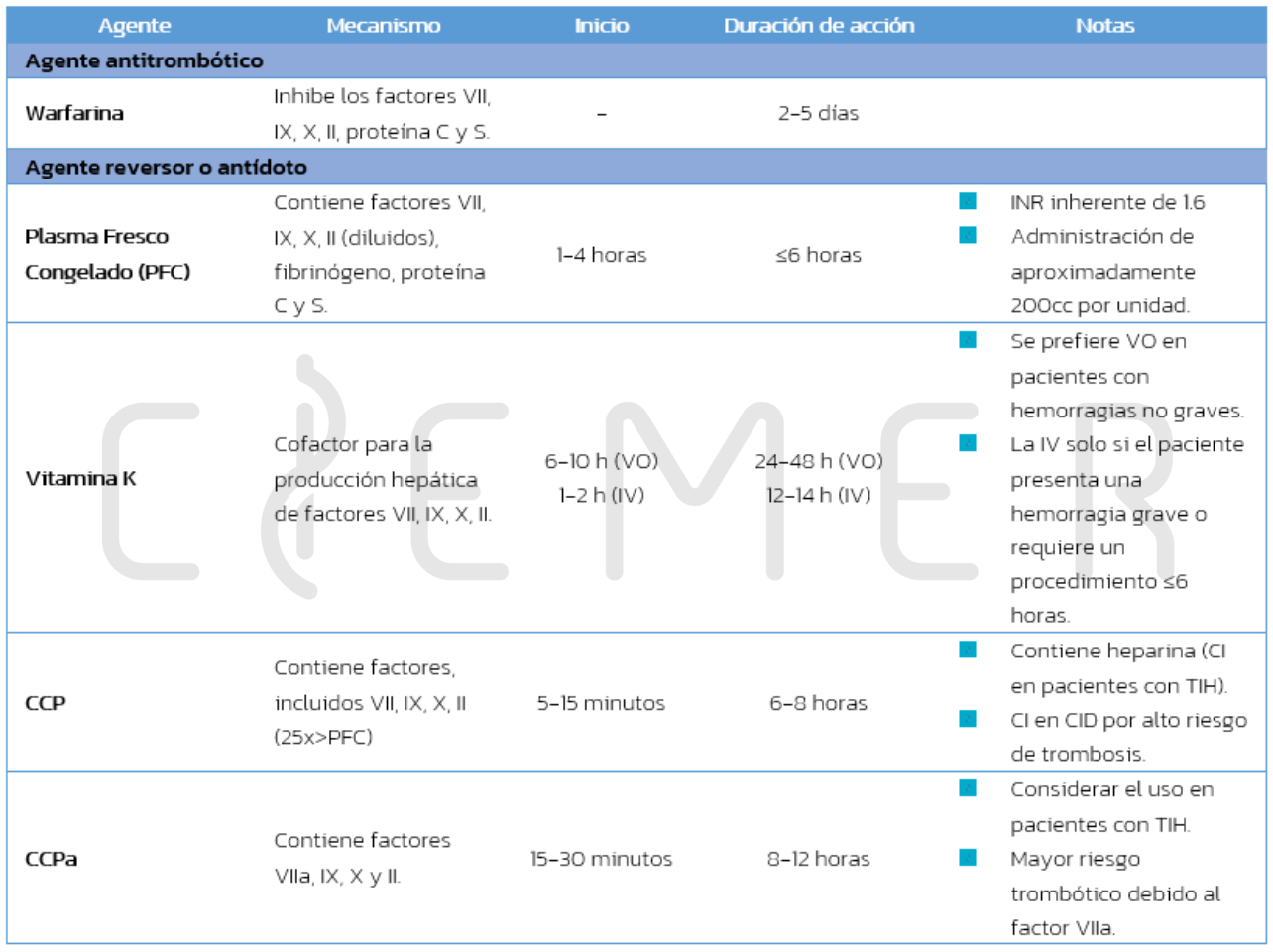
Warfarina
- Es un antagonnista de la vittamina KK.
- Puede mantenersse o disminuirse la dosiss, con corrección dell INR en 2-5 días en la mayoríaa de los casos.
- Se debe investigar la causa de la elevación del INR.
- El efecto completo de la vitamina K se produce aproximadamente 24 horas después de su administración.
- Pueden observarse efectos parciales en 6-12 horas, por lo que otras terapias pueden ser necesarias si requiere una reversión rápida.
- NO administrar por vía subcutánea o intramuscular debido a la absorción errática.
- El Concentrado Complejo Protrombínico (CCP) o el Concentrado Complejo Protrombínico Activado (CPPa) se deben usar cuando requiere una reversión rápida.
Farmacocinética / Farmacodinamia
Manejo del sangrado asociado a Warfarina
Dabigatrán
Farmacocinética / Farmacodinamia
Manejo del sangrado asociado a Dabigatrán
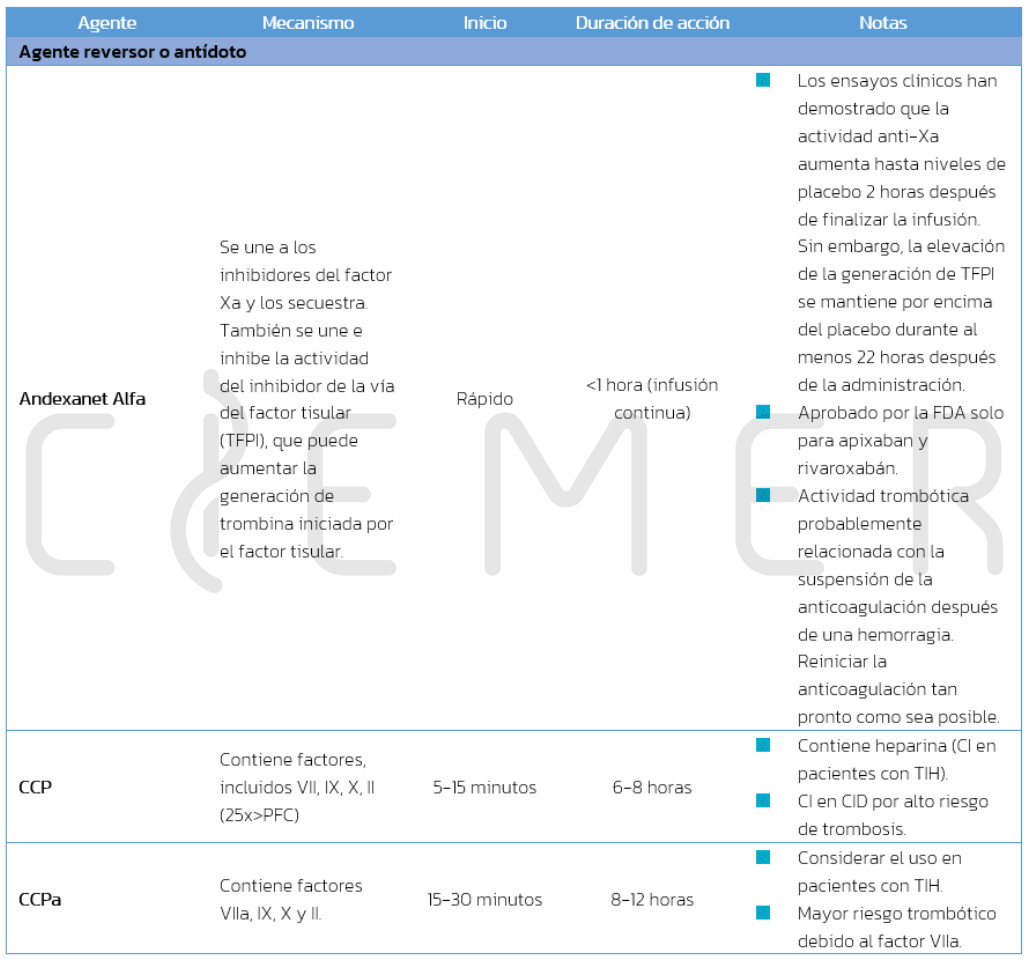
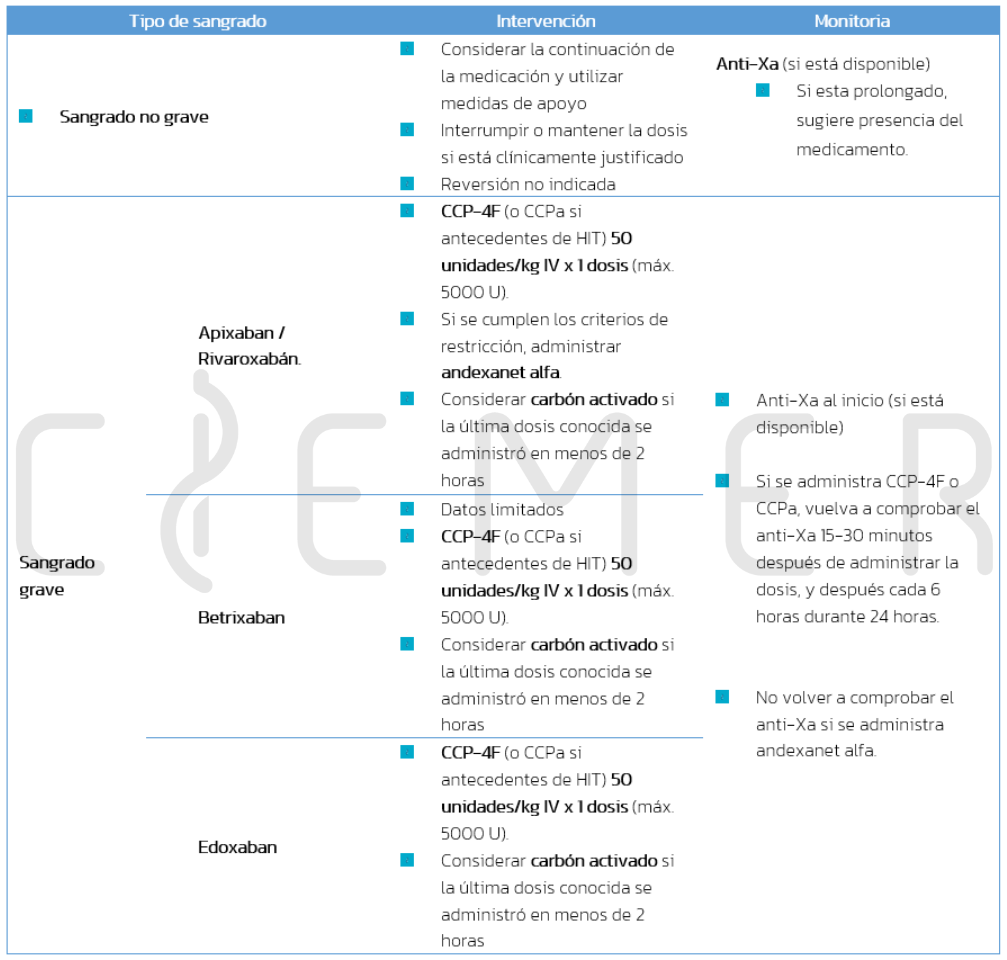
Apixaban, Betrixaban, Edoxaban, Rivaroxaban.
Farmacocinética / Farmacodinamia
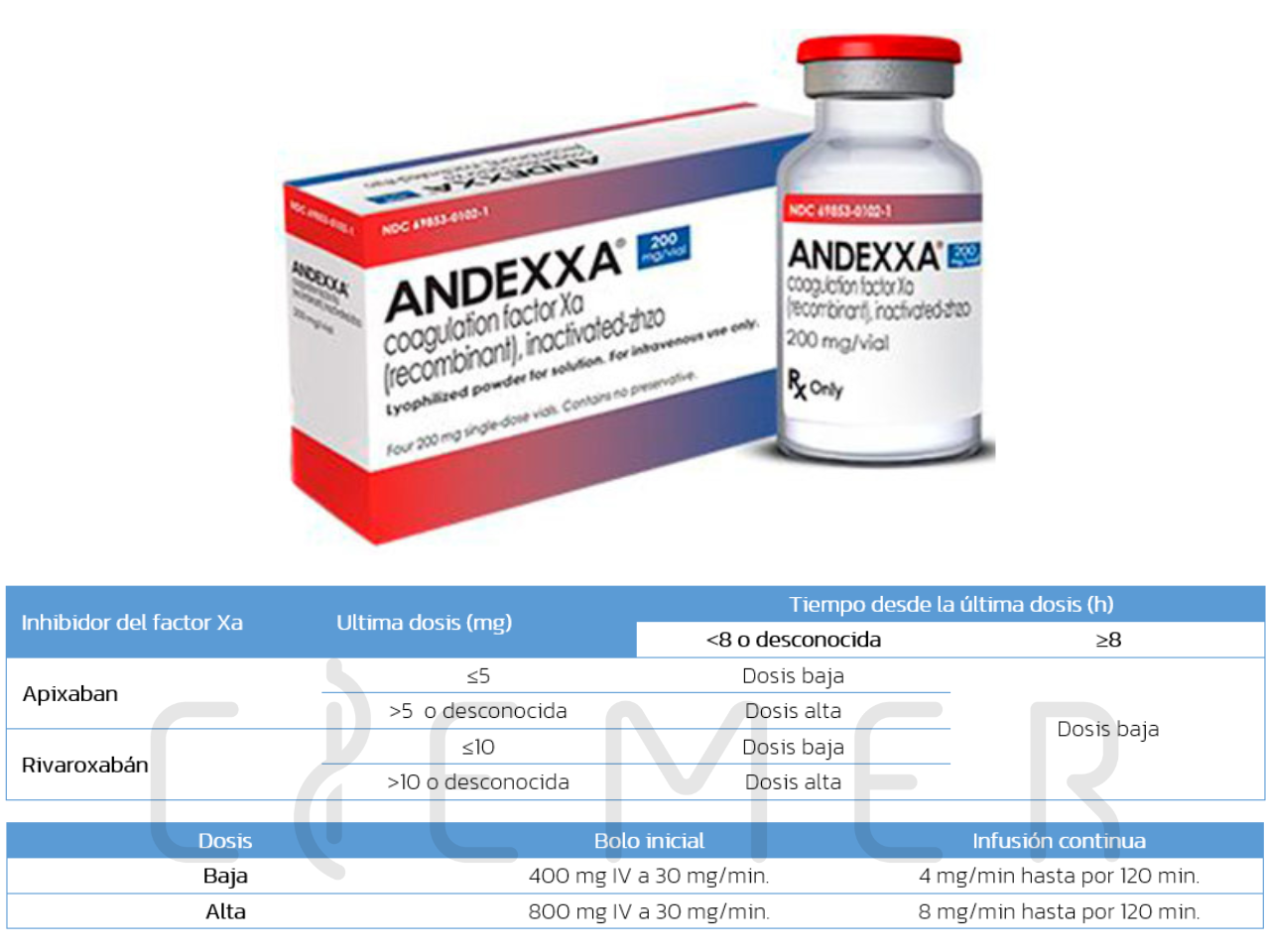
Manejo del sangrado asociado a Apixaban, Betrixaban, Edoxaban, Rivaroxaban.
Dosis Andexanet Alfa
Anticoagulantes parenterales y subcutáneos.
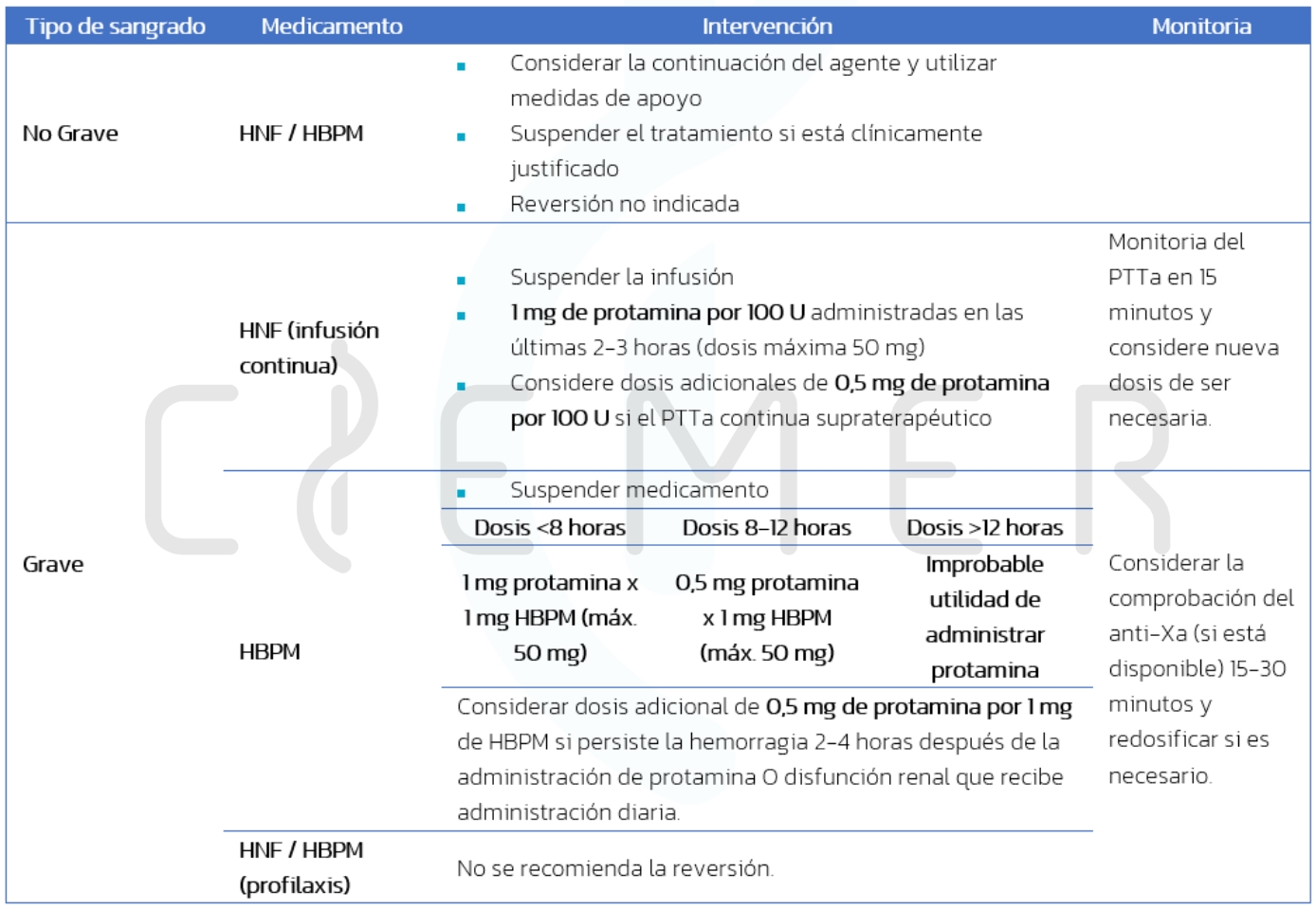
HBPM y HNF
- La mayoría de los efectos farmacológicos se pueden corregir sin intervención en la mayoría de los pacientes.
- 4-6 horas para la HNF
- 12-24 horas para las HBPM
- Neutralización completa de la HNF (en 5 minutos), sin embargo la neutralización es incompleta para la enoxaparina (~60%)
- La protamina puede causar hipotensión, bradicardia, vasoconstricción pulmonar y reacciones anafilactoides (debe administrarse <5 mg/min)
- NO utilizar PFC para la reversión de heparinas
Farmacocinética / Farmacodinamia
Manejo del sangrado asociado a las heparinas.
Fondaparinux
- Los efectos farmacológicos pueden corregirse sin intervenciones en 2-5 días en la mayoría de los pacientes; puede tomarse más tiempo en pacientes con alteraciones renales.
- La protamina y/o la diálisis no son eficaces para revertir o eliminar el fondaparinux.
Farmacocinética / Farmacodinamia
Manejo del sangrado asociado al fondaparinux
Para llevar a casa...
- Aún no contamos con un reversor específico para las HBPM, sin embargo continúa siendo una piedra angular en el manejo la protamina.
- El diagnóstico y tratamiento óptimos de los pacientes con hemorragias asociadas al uso de anticoagulantes sigue teniendo muchas controversias.
- La suspensión del medicamento anticoagulante se debe realizar de forma inmediata con hemorragia crítica desconocida.
- Continúa siendo un problema el no tener ampliamente disponible las mediciones de anticoagulación para los DOACs.
- Las pruebas de laboratorio estándar no reflejan de forma confiable el efecto de los DOACs sobre la hemostasia.
- En la medida de lo posible y teniendo en cuenta la disponibilidad, siempre debe usarse el antídoto o reversor específico.
- Para el caso del fondaparinux, sigue habiendo mucha controversia en cuanto a la reversión de su efecto anticoagulante.
Bibliografía
- Abeyaratne, M. R., Porter, I. A., & Walder, D. N. (1964). Effect of glycerol on the resistance of blood and plasma clots to the action of proteolytic enzymes. Nature, 202(4927), 98–99. https://doi.org/10.1038/202098a0
- Alotaibi, G. S., Wu, C., Senthilselvan, A., & McMurtry, M. S. (2016). Secular trends in incidence and mortality of acute venous thromboembolism: The AB-VTE population-based study. The American Journal of Medicine, 129(8), 879.e19-879.e25. https://doi.org/10.1016/j.amjmed.2016.01.041
- Baradarian, R., Ramdhaney, S., Chapalamadugu, R., Skoczylas, L., Wang, K., Rivilis, S., Remus, K., Mayer, I., Iswara, K., & Tenner, S. (2004). Early intensive resuscitation of patients with upper gastrointestinal bleeding decreases mortality. The American Journal of Gastroenterology, 99(4), 619-622. https://doi.org/10.1111/j.1572-0241.2004.04073.x
- Barnes, G. D., Lucas, E., Alexander, G. C., & Goldberger, Z. D. (2015). National trends in ambulatory oral anticoagulant use. The American Journal of Medicine, 128(12), 1300-1305.e2. https://doi.org/10.1016/j.amjmed.2015.05.044
- Baugh, C. W., Levine, M., Cornutt, D., Wilson, J. W., Kwun, R., Mahan, C. E., Pollack, C. V., Jr, Marcolini, E. G., Milling, T. J., Jr, Peacock, W. F., Rosovsky, R. P., Wu, F., Sarode, R., Spyropoulos, A. C., Villines, T. C., Woods, T. D., McManus, J., & Williams, J. (2020). Anticoagulant reversal strategies in the emergency department setting: Recommendations of a multidisciplinary expert panel. Annals of Emergency Medicine, 76(4), 470–485. https://doi.org/10.1016/j.annemergmed.2019.09.001
- Carson, J. L., Guyatt, G., Heddle, N. M., Grossman, B. J., Cohn, C. S., Fung, M., Gernsheimer, T., Holcomb, J. B., Kaplan, L. J., Katz, L. M., Peterson, N., Ramsey, G., Rao, S. V., Roback, J. D., Shander, A., & Tobian, A. A. (2016). Clinical practice guidelines from the AABB. JAMA, 316(19), 2025. https://doi.org/10.1001/jama.2016.9185
- Contreras, M. (1998). Final statement from the Consensus Conference on platelet transfusion. Transfusion, 38(8), 796-797. https://doi.org/10.1046/j.1537-2995.1998.38898375520.x
- Frontera, J. A., Lewin, J. J., III, Rabinstein, A. A., Aisiku, I. P., Alexandrov, A. W., Cook, A. M., del Zoppo, G. J., Kumar, M. A., Peerschke, E. I. B., Stiefel, M. F., Teitelbaum, J. S., Wartenberg, K. E., & Zerfoss, C. L. (2016). Guideline for reversal of antithrombotics in intracranial hemorrhage: A statement for healthcare professionals from the neurocritical care society and society of critical care medicine. Neurocritical Care, 24(1), 6–46. https://doi.org/10.1007/s12028-015-0222-x
- Gil, L., & Mario, J. (2022). Frecuencia de eventos trombóticos y sangrado en pacientes usuarios de la clínica anticoagulación del Hospital Militar Central 2019-2020. Medicina Interna.
- Holbrook, A., Schulman, S., Witt, D. M., Vandvik, P. O., Fish, J., Kovacs, M. J., Svensson, P. J., Veenstra, D. L., Crowther, M., & Guyatt, G. H. (2012). Evidence-based management of anticoagulant therapy. Chest, 141(2), e152S-e184S. https://doi.org/10.1378/chest.11-2295
- Huang, W., Goldberg, R. J., Anderson, F. A., Kiefe, C. I., & Spencer, F. A. (2014). Secular trends in occurrence of acute venous thromboembolism: The Worcester VTE study (1985-2009). The American Journal of Medicine, 127(9), 829-839.e5. https://doi.org/10.1016/j.amjmed.2014.03.041
- Institute for Safe Medication Practices. Quarter Watch. (2017). Part II: Oral Anticoagulants—The Nation’s Top Risk of Acute Injury from Drugs. July 27, 2017. Ismp.org. https://www.ismp.org/resources/quarterwatchtm-2016-annual-report-part-ii-oral-anticoagulants-nations-top-risk-acute
- Lavalle, C., Mariani, M. V., Piro, A., Magnocavallo, M., Vetta, G., Trivigno, S., Forleo, G. B., Della Rocca, D. G., Uguccioni, M., Russo, V., Summaria, F., & Di Lullo, L. (2022). Five years of direct oral anticoagulants use in Italy: Adverse drug reactions from the Italian National Pharmacovigilance Network. Journal of Clinical Medicine, 11(11), 3207. https://doi.org/10.3390/jcm11113207
- Monroe, D. M., Roberts, H. R., & Hoffman, M. (1994). Platelet procoagulant complex assembly in a tissue factor‐initiated system. British Journal of Haematology, 88(2), 364–371. https://doi.org/10.1111/j.1365-2141.1994.tb05032.x
- Mozaffarian, D., Benjamin, E. J., Go, A. S., Arnett, D. K., Blaha, M. J., Cushman, M., Das, S. R., de Ferranti, S., Després, J.-P., Fullerton, H. J., Howard, V. J., Huffman, M. D., Isasi, C. R., Jiménez, M. C., Judd, S. E., Kissela, B. M., Lichtman, J. H., Lisabeth, L. D., Liu, S., … Turner, M. B. (2016). Heart disease and stroke statistics—2016 update: A report from the American heart association. Circulation, 133(4). https://doi.org/10.1161/cir.0000000000000350
- Mulloy, B., Barrowcliffe, T., & Gray, E. (2008). Heparin and low-molecular-weight heparin. Thrombosis and Haemostasis, 99(11), 807–818. https://doi.org/10.1160/th08-01-0032
- Pérez-Gómez, F., & Bover, R. (2007). La nueva cascada de la coagulación y su posible influencia en el difícil equilibrio entre trombosis y hemorragia. Revista espanola de cardiologia, 60(12), 1217–1219. https://doi.org/10.1157/13113924
- Razzaghi, A., & Barkun, A. N. (2012). Platelet transfusion threshold in patients with upper gastrointestinal bleeding. Journal of Clinical Gastroenterology, 46(6), 482-486. https://doi.org/10.1097/mcg.0b013e31823d33e3
- Schafer, A.I. (1994) Coagulation Cascade: An Overview. In: Loscalzo, J. and Schafer, A.I., Eds., Thrombosis and Haemorrhage, Blackwell Scientific, Boston, 3-12.
- Shehab, N., Lovegrove, M. C., Geller, A. I., Rose, K. O., Weidle, N. J., & Budnitz, D. S. (2016). US emergency department visits for outpatient adverse drug events, 2013-2014. JAMA: The Journal of the American Medical Association, 316(20), 2115. https://doi.org/10.1001/jama.2016.16201
- Spoerke, N. J., Michalek, J. E., & Schreiber, M. A. (2011). Crystalloid resuscitation improves survival in trauma patients receiving low ratios of fresh frozen plasma to packed red blood cells. Journal of Trauma-injury Infection and Critical Care, 71(2), S380-S383. https://doi.org/10.1097/ta.0b013e318227f1c5
- Tomaselli, G. F., Mahaffey, K. W., Cuker, A., Dobesh, P. P., Doherty, J. U., Eikelboom, J. W., Florido, R., Gluckman, T. J., Hucker, W. J., Mehran, R., Messé, S. R., Perino, A. C., Rodriguez, F., Sarode, R., Siegal, D. M., & Wiggins, B. S. (2020). 2020 ACC expert consensus decision pathway on management of bleeding in patients on oral anticoagulants. Journal of the American College of Cardiology, 76(5), 594–622. https://doi.org/10.1016/j.jacc.2020.04.053
- White, K., Faruqui, U., & Cohen, A. (2022). New agents for DOAC reversal: a practical management review. The British journal of cardiology. https://doi.org/10.5837/bjc.2022.001
- Ziakas, P. D., Kourbeti, I. S., Poulou, L. S., Vlachogeorgos, G. S., & Mylonakis, E. (2018). Medicare part D prescribing for direct oral anticoagulants in the United States: Cost, use and the “rubber effect”. PloS One, 13(6), e0198674. https://doi.org/10.1371/journal.pone.0198674

Especialista en medicina de emergencias
Docente universitario
Aspirante a Magister en educación